题目内容
7.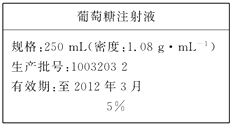 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下页图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.现在有实验用品:葡萄糖晶体(摩尔质量:180g/mol)、蒸馏水、烧杯、容量瓶(500mL)、药匙、胶头滴管、量筒.
(1)还缺少的仪器有托盘天平、玻璃棒;
(2)下列对容量瓶及其使用方法的描述中正确的是A;
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标有容积、温度和浓度
(3)实验中需取用晶体的质量为27 g,物质的量浓度_0.3 mol/L_;
(4)配制该溶液时,下列操作会导致所配溶液的物质的量浓度偏高的是B.
A.没有将洗涤液转移到容量瓶 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线.
分析 (1)根据配制一定物质的量浓度溶液的操作步骤选取实验仪器;
(2)根据容量瓶的构造及容量瓶的正确使用方法进行解答;
(3)根据体积、密度可计算溶液的质量,再利用葡萄糖的质量分数来计算葡萄糖的质量;根据c=$\frac{n}{V}$来计算;
(4)分析操作对溶质的物质的量、溶液体积的影响,根据c=$\frac{n}{V}$分析操作对所配溶液浓度的影响.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:托盘天平、玻璃棒;
故答案为:托盘天平、玻璃棒;
(2)A.容量瓶带有活塞,使用过程中需要上下颠倒,所以使用前应检查是否漏水,故A正确;
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
D.容量瓶上标有容积、温度和刻度线,故D错误;
故选:A;
(3)葡萄糖(C6H12O6)注射液的密度为1.08g•mL-1,500mL溶液,葡萄糖的质量分数5%,则含葡萄糖的质量为:500mL×1.08g/cm3×5%=27.0g,葡萄糖的物质的量为$\frac{27.0g}{180g/mol}$=0.15mol,溶质的物质的量浓度为$\frac{0.15mol}{0.5L}$=0.3mol/L,
故答案为:27.0;0.3mol/L;
(4)A.没有将洗涤液转移到容量瓶,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.定容时俯视读取刻度,导致溶液体积偏小,溶液浓度偏高,故B选;
C.原容量瓶洗净后未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.定容时液面超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:B.
点评 本题考查一定物质的量浓度溶液的配制及误差分析,难度中等,注意根据$\frac{n}{V}$理解溶液配制与误差分析,注意容量瓶的构造及使用方法.

| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中的值$\frac{C{H}_{3}COOH}{C{H}_{3}CO{O}^{-}}$减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
| A. | 酸碱滴定管装标准溶液前,必须先用该溶液润洗 | |
| B. | 滴定过程中眼睛应注视滴定管内液面变化 | |
| C. | 锥形瓶用蒸馏水洗涤后直接盛放待测液,对滴定结果无影响 | |
| D. | 用50mL酸式滴定管可准确量取25.00LHCl溶液 |
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能发生反应 | |
| C. | 反应物和生成物所具有的总能量决定了放热还是吸热 | |
| D. | 吸热反应只能在加热的条件下才能进行 |
| A. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 醋酸能与NaHCO3溶液反应放出CO2 | |
| C. | 醋酸的导电性比盐酸溶液的弱 | |
| D. | 10 mL 1 mol•L-1醋酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 |
 ol·L-1
ol·L-1

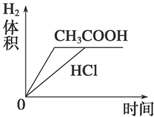
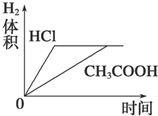
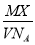 表示的是
表示的是