题目内容
3.为了增强漂白粉的漂白能力,常在漂白粉溶液中加入少量的( )| A. | NaOH | B. | NaCl | C. | HCl | D. | Ca(ClO)2 |
分析 漂白粉的有效成分为次氯酸钙,可与酸反应生成具有漂白性的次氯酸,则增强漂白能力,应加入酸,以此解答.
解答 解:漂白粉是混合物,主要成分是Ca(ClO)2和CaCl2,有效成分是Ca(ClO)2,
氯酸钙可与酸反应生成具有漂白性的次氯酸,则增强漂白能力,应加入酸,
题给物质中只有盐酸符合,发生Ca(ClO)2+2HCl=CaCl2+2HClO,
故选C.
点评 本题考查含氯化合物的重要应用,为高频考点,侧重于化学与生活的考查,有利于培养学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣ | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
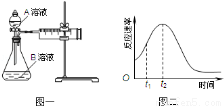
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .
12.用物质的量都是0.1mol的NH3•H2O和NH4Cl配成1L混合溶液,已知其中c(NH4+)大于c(Cl-),对该混合溶液的下列判断正确的是( )
| A. | c(H+)>c(OH-) | B. | c(NH4+)+c(NH3•H2O)=0.2 mol•L-1 | ||
| C. | c(NH3•H2O)>c(NH4+) | D. | c(NH4+)+c(H+)=0.2 mol•L-1 |
8.配置一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( )
| A. | 定容时俯视液面 | B. | 容量瓶洗净后有少量水残留 | ||
| C. | 转移时没有洗涤烧杯和玻璃 | D. | 所用的氢氧化钠已吸水潮解 |
12.下列关于酸碱中和滴定的说法错误的是( )
| A. | 酸碱滴定管装标准溶液前,必须先用该溶液润洗 | |
| B. | 滴定过程中眼睛应注视滴定管内液面变化 | |
| C. | 锥形瓶用蒸馏水洗涤后直接盛放待测液,对滴定结果无影响 | |
| D. | 用50mL酸式滴定管可准确量取25.00LHCl溶液 |
 1H2C2O4溶液
1H2C2O4溶液