题目内容
12.Fe、Al、Cu能与许多其它金属形成金属互化物,Cu9Al4就是其中一种重要的金属互化物,回答下列问题.(1)Cu9Al4具有自范性,原子在三维空间里呈周期性有序排列,Cu9Al4属于晶体(填“晶体”或“非晶体”)
(2)Fe、Al、Cu三种元素基态原子中未成对电子最多的是Fe(填元素符号).
(3)Cu9Al4与盐酸反应后生成AlCl3,氯化铝可做为下列反应的催化剂
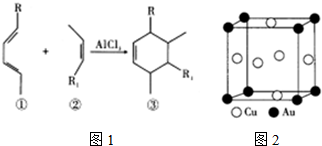
①分子③中碳原子杂化类型.
②已知AlCl3•NH3和AlCl4-中均有配位键.AlCl3•NH3中,提供空轨道的原子是Al;
(4)铜能与(SCN)2反应,(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸不能
(5)一种铜金互化物具有立方最密堆积的结构,如图2所示该金属互化物中Cu原子与Au原子个数之比为3:1;该互化物中微粒之间的强相互作用是金属键.
分析 (1)根据晶体和非晶体中微粒的排列特点分析;
(2)根据元素的外围电子排布分析;
(3)①分子③中碳原子以C=C和C-C键的形式存在,根据C原子的价层电子对数判断;
②含有孤对电子的原子提供孤对电子,中心原子提供空轨道;
(4)能形成分子间氢键的物质熔沸点较高;
(5)利用均摊法计算晶胞中含有的原子个数来确定原子个数之比,金属晶体中存在金属键.
解答 解:(1)晶体中粒子在三维空间里呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,
故答案为:晶体;
(2)Fe的外围电子排布为3d64s2,含有4个未成对电子,Al的外围电子排布为3s23p1,含有一个未成对电子,Cu的外围电子排布为3d104s1,含有一个未成对电子,所以Fe的未成对电子最多;
故答案为:Fe;
(3)①分子③中碳原子以C=C和C-C键的形式存在,C=C中C原子的价层电子对数为3,为sp2杂化,C-C中C原子的价层电子对数为4,为sp3杂化;
故答案为:sp2、sp3;
②AlCl3•NH3中Al为中心原子,NH3和Cl-为配体,中心原子Al提供空轨道;
故答案为:Al;
(4)能形成分子间氢键的物质熔沸点较高,异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,
故答案为:异硫氰酸分子间可形成氢键,而硫氰酸不能;
(5)在晶胞中Cu原子处于面心,Au原子处于顶点位置,所以该晶胞中含有铜原子个数=6×$\frac{1}{2}$=3,金原子个数=8×$\frac{1}{8}$=1,则该合金中Cu原子与Au原子数量之比为3:1,金属晶体中含有金属键;
故答案为:3:1;金属键.
点评 本题考查物质结构和性质,侧重考查学生空间想象能力及计算能力,涉及晶体与非晶体、核外电子排布、原子的杂化、配位键、氢键、晶体的计算等知识点,主要是图象分析和数据分析、杂化理论的理解应用,题目难度中等.

| A. | Fe和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Mg和Zn |
| A. | 一定温度下,将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,电离度和Ka(HF)保持不变,$\frac{c({F}^{-})}{c(HF)}$始终保持增大 | |
| B. | 浓度均为0.1mol•L-1的Na2SO3、NaHSO3混合溶液中:3c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,恰好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol•L-1 | |
| D. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl |
| A. | 油炸薯条 | B. | 碳酸饮料 | C. | 烤羊肉串 | D. | 新鲜蔬菜 |
| A. | 恒容通入惰性气体 | B. | 恒压时通入惰性气体 | ||
| C. | 恒容通入COCl2气体 | D. | 加催化剂 |
| A. | 原子半径:Na>Si>O | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 碱性:CsOH>KOH>NaOH | D. | 失电子能力:Al>Mg>Na |
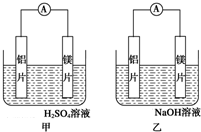 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.