题目内容
12.决定化学反应速率的主要因素是( )| A. | 温度和压强 | B. | 催化剂 | ||
| C. | 参加反应物质的性质 | D. | 各反应物和生成物的浓度 |
分析 反应物的本性为决定反应速率的内因,以此来解答.
解答 解:反应物的性质为决定化学反应速率的主要因素,而温度、浓度、催化剂均为影响反应速率的外界因素,
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握速率的影响因素及内因、外因的差异为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
| A. | CH4 | B. | BF3 | C. | CO2 | D. | N2 |
3.在下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | NaCl+H2SO4(浓) | B. | Cu+H2SO4(浓) | C. | C+H2SO4(浓) | D. | CuO+H2SO4(浓) |
7. 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:
请回答下列问题:
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
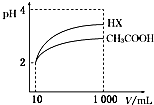
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
 25℃时,三种酸的电离常数为:
25℃时,三种酸的电离常数为:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)物质的量浓度为0.1mol/L的下列物质:a.Na2CO3、b.NaClO、c.CH3COONa、d.NaHCO3;pH由大到小的顺序是:abdc(填编号)
(2)常温下0.1mol/L的CH3COOH在水中约有1%发生电离,其溶液的pH=3,将该溶液加蒸馏水稀释,在稀释过程中,下列表达式的数据变大的是:BD.
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(3)体积为10mL pH=2的醋酸溶液与一元酸HX分别加蒸馏水稀释至1 000mL,稀释过程pH变化如图;则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来的c(H+)(填“大于”、“等于”或“小于”).
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=9.9×10-7mol/L(填准确数值).
17.在第ⅦA族元素的卤化氢中,最容易分解成单质的是( )
| A. | HI | B. | HBr | C. | HCl | D. | HF |
2.由两种金属组成的混合物12g,与足量的稀H2SO4反应后,在标准状况下产生H2为11.2L,这种金属混合物可能是( )
| A. | Fe和Al | B. | Fe和Zn | C. | Mg和Cu | D. | Mg和Zn |

 (甘氨酸)
(甘氨酸)
 ;
; $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
. 至少需要a步化学反应.
至少需要a步化学反应.
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O