题目内容
9.设阿伏加德罗常数的值为NA.下列叙述正确的是( )| A. | 1.0L 0.1mol/L NH4C1溶液中NH4+的个数为0.1NA | |
| B. | Cu-Zn原电池中,正极产生1.12L H2时,转移的电子数为0.1NA | |
| C. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 一定条件下,28g N2与6gH2反应生成的NH3分子数为2NA |
分析 A.氨根离子为弱碱阳离子,水溶液中部分水解;
B.气体状况未知;
C.根据PH=-lg[H+]、[H+][OH-]=Kw、n=cV来计算;
D.氮气与氢气反应生成氨气为可逆反应,不能进行到底.
解答 解:A.氨根离子为弱碱阳离子,水溶液中部分水解,所以1.0L 0.1mol/L NH4C1溶液中NH4+的个数小于0.1NA,故A错误;
B.气体状况未知,Vm不确定,无法计算氢气的物质的量及电子转移数,故B错误;
C.pH=13的 Ba(OH)2溶液,[H+]=10-13mol/L,依据[H+][OH-]=Kw,[OH-]=10-1mol/L,25℃、pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为10-1mol/L×1L=0.1mol,含有的OH-数目为0.1NA,故C正确;
D.氮气与氢气反应生成氨气为可逆反应,不能进行到底,所以28g N2与6gH2反应生成的NH3分子数小于2NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,综合性较强,充分考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
19.下列各组物质能用分液漏斗分离的是( )
| A. | 植物油和水的混合物 | B. | 含泥沙的食盐水 | ||
| C. | 乙醇的水溶液 | D. | 硫酸钡和氯化银的固体混合物 |
20.下列关于如图所示装置的说法,正确的是( )
| A. | 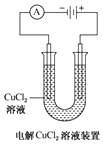 装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝 | |
| B. | 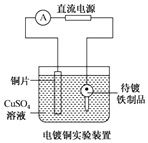 装置中待镀铁制品应与电源正极相连 | |
| C. | 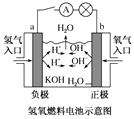 装置外电路中电子由a极流向b极 | |
| D. | 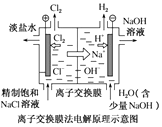 装置中的阴离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
17.下列说法正确的是( )
| A. | 新制的氯水保存在无色玻璃瓶中 | |
| B. | 氢气在氯气中燃烧生成白色烟雾 | |
| C. | 向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 | |
| D. | 常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |
14.实验室里保存下列试剂的方法,有错误的是( )
| A. | 新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 液溴易挥发,盛放在用水液封、用橡皮胶塞密封的棕色试剂瓶中 | |
| C. | 碘易升华,盛放在棕色试剂瓶中 | |
| D. | 浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中 |
1.下列叙述不正确的是( )
| A. | 金属的电化腐蚀比化学腐蚀普遍 | B. | 钢铁在干燥空气里不易腐蚀 | ||
| C. | 用铝质铆钉接铁板,铁板易被腐蚀 | D. | 原电池电路中电子由负极流入正极 |
18.关于Na2CO3和NaHCO3性质的说法正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度时的水溶性:Na2CO3<NaHCO3 | |
| C. | 等物质的量浓度的溶液的碱性:Na2CO3<NaHCO3 | |
| D. | 与同浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
2.宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag+2H2S+O2═2X+2H2O,下列说法正确的是( )
| A. | X的化学式为AgS | B. | 每生成1mo1X转移2mo1电子 | ||
| C. | 反应的还原剂是H2S | D. | 银针验毒时,空气中氧气失去电子 |