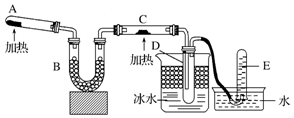
题目内容
18.关于Na2CO3和NaHCO3性质的说法正确的是( )| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度时的水溶性:Na2CO3<NaHCO3 | |
| C. | 等物质的量浓度的溶液的碱性:Na2CO3<NaHCO3 | |
| D. | 与同浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
分析 A.碳酸氢钠受热易分解生成碳酸钠;
B.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出;
C.碳酸钠的水解程度大于碳酸氢钠,所以等物质的量浓度的溶液碳酸钠的碱性强于碳酸氢钠;
D、分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑.
解答 解:A、NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,碳酸钠受热稳定,故A正确;
B、常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故B错误;
C、碳酸钠的水解程度大于碳酸氢钠,所以等物质的量浓度的溶液碳酸钠的碱性强于碳酸氢钠,所以碱性:Na2CO3>NaHCO3,故C错误;
D、分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故D错误;
故选:A.
点评 本题考查Na2CO3和NaHCO3性质,题目难度不大,注意把握Na2CO3和NaHCO3性质的异同,注重基础知识的积累.

练习册系列答案
相关题目
8.下列有关实验操作能达到实验目的或得出相应结论正确的是( )
| A. | 将溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,可检验溴元素 | |
| B. | 用新制Cu(OH)2悬浊液和氢氧化钠溶液可鉴别乙醛、乙酸和甲酸三种无色水溶液 | |
| C. | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀,说明蔗糖没有水解 | |
| D. | 向蛋白质溶液中滴加CuSO4溶液,有白色固体析出,加水后不固体溶解,说明蛋白质的盐析是不可逆的 |
9.设阿伏加德罗常数的值为NA.下列叙述正确的是( )
| A. | 1.0L 0.1mol/L NH4C1溶液中NH4+的个数为0.1NA | |
| B. | Cu-Zn原电池中,正极产生1.12L H2时,转移的电子数为0.1NA | |
| C. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 一定条件下,28g N2与6gH2反应生成的NH3分子数为2NA |
6.“非典”时期,人们常用的“84”消毒液的有效成分是( )
| A. | NaCl | B. | NaClO | C. | 双氧水 | D. | 苯酚 |
10.分别进行如表所示实验,现象和结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN浓液 | 有气体生成,溶液未呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4- |
| D | 将0.1mol/LMgSO4溶液滴入NaOH溶液里至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp小于Mg(OH)2的Ksp |
| A. | A | B. | B | C. | C | D. | D |
11.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 80g硝酸铵含有氮原子数为2NA | |
| B. | 1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L蒸馏水所含分子数为0.5NA | |
| D. | 在铜与硫的反应中,1mol铜失去的电子数为2NA |
 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.