题目内容
14.实验室里保存下列试剂的方法,有错误的是( )| A. | 新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 液溴易挥发,盛放在用水液封、用橡皮胶塞密封的棕色试剂瓶中 | |
| C. | 碘易升华,盛放在棕色试剂瓶中 | |
| D. | 浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中 |
分析 A.依据次氯酸见光易分解的性质解答;
B.依据液溴的强氧化性解答;
C.依据碘易升华的性质解答;
D.依据浓盐酸为液体,易挥发的性质解答.
解答 解:A.氯水中的次氯酸见光分解,所以应盛放在棕色试剂瓶中,存放于低温避光的地方,故A正确;
B.液溴具有强氧化性,能够使橡胶老化,所以不能用橡皮胶塞保存,故B错误;
C.碘易升华,盛放在棕色试剂瓶中,故C正确;
D.浓盐酸为液体,易挥发,应盛装在无色密封的细口玻璃试剂瓶中,故D正确;
故选:B.
点评 本题主要考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
9.设阿伏加德罗常数的值为NA.下列叙述正确的是( )
| A. | 1.0L 0.1mol/L NH4C1溶液中NH4+的个数为0.1NA | |
| B. | Cu-Zn原电池中,正极产生1.12L H2时,转移的电子数为0.1NA | |
| C. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 一定条件下,28g N2与6gH2反应生成的NH3分子数为2NA |
19.表是25℃时四种酸的电离平衡常数:
(1)用离子方程式表示NaNO2溶液呈碱性的原因NO2-+H2O?HNO2+OH-
(2)25℃时,向向0.1mol•L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为c(Na+)>c(A-)>c(OH-)>c(H+)
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行
(6)已知NaHCO3溶液中存在HCO3??H++CO32-,加水稀释时溶液中的c(H+)将增大(填“增大”或“减小”)
| 化学式 | CH3COOH | HA | HNO2 | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1 =4.1×10-7 Ka2 =5.6×10-11 |
(2)25℃时,向向0.1mol•L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
(3)写出NaA溶液中通少量CO2的离子方程式A-+CO2+H2O=HA+HCO3-
(4)25℃时,等物质的量浓度的HA、NaA混合溶液呈碱性,溶液中各离子浓度的大小顺序为c(Na+)>c(A-)>c(OH-)>c(H+)
(5)已知HNO2不稳定,在稀溶液中也易分解生成NO与NO2,某同学分别取少量NaCl溶液与NaNO2溶液于试管中,分别滴加浓醋酸,以此来鉴别失去标签的NaCl溶液和NaNO2溶液,该方法可行(填“可行”或“不可行”),理由是NaNO2+CH3COOH?CH3COONa+HNO2,2HNO2=H2O+NO+NO2,HNO2不稳定会分解,使平衡不断朝生成亚硝酸的方向移动,可观察到有红棕色气体产生,故此方法可行
(6)已知NaHCO3溶液中存在HCO3??H++CO32-,加水稀释时溶液中的c(H+)将增大(填“增大”或“减小”)
6.“非典”时期,人们常用的“84”消毒液的有效成分是( )
| A. | NaCl | B. | NaClO | C. | 双氧水 | D. | 苯酚 |
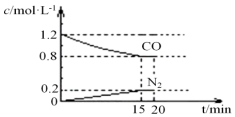 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.