题目内容
18.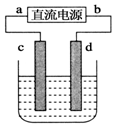 如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )
如图,电解质溶液是NaCl的水溶液,过一段时间发现d极附近有黄绿色气体产生,(c、d均为石墨电极)以下说法正确的是( )| A. | a是电源的正极 | B. | 电子流动的方向:d→b | ||
| C. | c极发生氧化反应 |
分析 电解质溶液是NaCl的水溶液,通电一段时间后发现d极附近有黄绿色气体产生,则产生氯气,该电极是阳极,根据电解池的工作原理进行回答即可.
解答 解:电解质溶液是NaCl的水溶液,通电一段时间后发现d极附近有黄绿色气体产生,所以d是阳极,b是正极,a是负极,c是阴极;
A、a是电源的负极,故A错误;
B、电子从阳极沿着导线流向阴极,即从d→b→a→c,故B正确;
C、c极是阴极,发生还原反应,故C错误;
故选B.
点评 本题考查学生电解池的工作原理知识,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
6.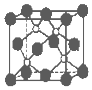 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )| A. | 磷化硼晶体的化学式为BP,属于离子晶体 | |
| B. | 磷化硼晶体的熔点高,且熔融状态下能导电 | |
| C. | 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 | |
| D. | 磷化硼晶体中每个原子均形成4个共价键 |
13.诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为( )
| A. | 3:3:2 | B. | 2:2:3 | C. | 3:28:27 | D. | 1:1:1 |
3.将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )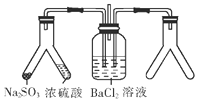

| A. | 大理石和稀盐酸 | B. | CaO和浓氨水 | C. | Cu和浓硝酸 | D. | MnO2和双氧水 |
10.下列叙述正确的是( )
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
8.下列有关非金属元素说法正确的是( )
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |

 气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:
气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系: .
.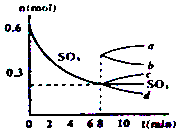 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: