题目内容
19.回答下列问题:某工业废水中含有一定量的Cr2O72-和CrO42-,二者存在平衡:
2CrO42-黄色)+2H+?Cr2O72-(橙色)+H2O
①若平衡体系滴加少量H2SO4(不考虑温度的影响),溶液显橙色..
②能说明该反应达平衡状态的是c.
a.Cr2O72-和CrO42--的浓度相同
b.2v (Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(2)H2O2稀溶液易被催化分解,可使用的催化剂为(填序号)ab.
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是:吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g).已知该反应的△H>0,简述该设想能否实现的依据:△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
③目前,火箭残骸中常出现红棕色气体,原因为:N2O4(g)?2NO2(g)当温度升高时,气体颜色变深,则反应为吸热(填“吸热”或“放热”)反应.
分析 (1)①根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O知,酸性条件下,平衡向正反应方向移动;
②当反应到达平衡状态时正逆反应速率相同、各物质的浓度保持不变;
(2)过氧化氢在二氧化锰或氯化铁作催化剂的条件下分解为水与氧气;
(3)①依据化学反应速率和平衡移动原理分析判断;
②根据G=△H-T•△S判断反应能否自发进行;
③当温度升高时,气体颜色变深,说明平衡正向移动,则反应为吸热反应.
解答 解:(1)①根据2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O知,酸性条件下,平衡向正反应方向移动,所以溶液呈橙色,故答案为:橙;
②a.Cr2O72-与CrO42-的浓度相同时正逆反应速率不一定相等,所以不一定是平衡状态,故错误;
b.2v(Cr2O72-)=v(CrO42-)时正逆反应速率不一定相等,所以不一定是平衡状态,故错误;
c.溶液的颜色不变,体系中各物质浓度不变,则该反应达到平衡状态,故c正确;
故答案为:c;
(2)过氧化氢在二氧化锰或氯化铁作催化剂的条件下分解为水与氧气,故答案为:ab;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:吸热反应,温度升高,平衡正向移动,NO的含量增大;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T•△S,G>0,不能实现,
故答案为:△H>0△S<0,则在任何温度下△G>0,不可能自发进行;
③当温度升高时,气体颜色变深,说明平衡正向移动,则反应为吸热反应,故答案为:吸热.
点评 本题考查了化学平衡移动、平衡状态的判断、氧化还原反应的有关计算,题目难度不大,注意把握发生的反应.

练习册系列答案
相关题目
10.下列叙述正确的是( )
| A. | 纯碱、烧碱均属碱 | B. | SiO2、CO2均属于酸性氧化物 | ||
| C. | 凡能电离出H+的化合物均属酸 | D. | 非金属氧化物一定是酸性氧化物 |
14.过程的自发性的作用是( )
| A. | 确定过程是否一定会发生 | B. | 判断过程的方向 | ||
| C. | 判断过程发生的速率 | D. | 判断过程的热效应和熵变 |
4.下列操作中正确的是( )
| A. |  加热液体 | B. |  加入固体粉末 | C. |  倾倒液体 | D. |  尾气吸收 |
11.向0.lmol/L NaOH溶液中通入过量的CO2后,溶液中存在的主要离子是( )
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
8.下列有关非金属元素说法正确的是( )
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
9.化学反应4A(s)+3B(g)?2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
| A. | 用A表示的反应速率是0.4 mol•(L•min)-1 | |
| B. | 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 | |
| C. | 2 min末的反应速率用B表示是0.3 mol•(L•min)-1 | |
| D. | 分别用B、C、D表示的反应速率其比值是3:2:1 |
 气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系:
气态烃A是一种基本的有机化工原料,目前石油裂解已成为生成A的主要方法.A在标准状况下的密度为1.25g•L-1.D的分子式为C4H8O2,D在酸性条件下水解得到B和C,C的相对分子质量比B大14.四种有机物之间存在如图转化关系: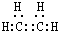 .
.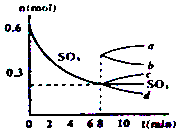 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: