题目内容
1.有反应:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.(1)Al元素的化合价升高,则该元素的原子失电子,被氧化(填“氧化”或“还原”);而Fe元素的化合价降低,则该元素的原子得电子,被还原(填“氧化”或“还原”).
(2)该反应中Fe2O3发生了还原反应,Al发生了氧化反应.用“双线桥法”表示反应中电子转移的方向和数目:
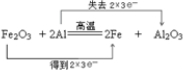 .
.
分析 反应2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,Al元素化合价升高,被氧化,为还原剂,Fe元素化合价降低,被还原,Fe2O3为氧化剂,结合化合价的变化计算,由此分析解答.
解答 解:(1)反应2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,Al元素化合价升高,该元素失电子被氧化,为还原剂,Fe元素化合价降低,该元素的原子得电子,被还原,故答案为:Al;失;氧化;Fe;得;还原;
(2)该反应中Fe2O3是氧化剂,发生了还原反应,Al是还原剂,发生了氧化反应,则Fe得到2×3e-,Al失去2×3e-,氧化产物为Al2O3,电子转移数目和方向可表示为 ,故答案为:还原;氧化;
,故答案为:还原;氧化; .
.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子数目的考查,题目难度不大.

练习册系列答案
相关题目
12.乙酸、碳酸、苯酚的酸性由强到弱的顺序是( )
| A. | 碳酸、苯酚、乙酸 | B. | 乙酸、碳酸、苯酚 | C. | 碳酸、苯酚、乙酸 | D. | 苯酚、碳酸、乙酸 |
9.既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是( )
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 通入水中 |
16.可逆反应2NO2?2NO+O2在恒容密闭容器中进行,下列情况达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体压强不再改变.
①单位时间内生成n mol O2的同时生成2n mol NO2 ②混合气体的平均相对分子质量不再改变
③NO2、NO、O2的反应速率之比为2:2:1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体压强不再改变.
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ①②⑤⑥ | D. | ①②④⑤ |
6.既能与稀硫酸反应,又能与NaOH溶液反应,且都有气体放出的是( )
| A. | NaHCO3 | B. | Al(OH)3 | C. | (NH4)2CO3 | D. | Al2O3 |
13.有4种有机物:① ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成
结构简式为 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )
 ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成结构简式为
 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | ①②④ |


 ,加聚反应.
,加聚反应.