题目内容
13.有4种有机物:① ②
② ③
③ ④CH3-CH═CH2-CN,其中可用于合成
④CH3-CH═CH2-CN,其中可用于合成结构简式为
 的高分子材料的正确组合为( )
的高分子材料的正确组合为( )| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | ①②④ |
分析 根据所给高聚物的结构简式和加聚反应原理可知主链上碳原子为不饱和碳原子,根据碳的4个价键规则可作如下的断键处理,断键后两半键闭合可得由高聚物的单体.
解答 解:根据所给高聚物的结构简式和加聚反应原理可知主链上碳原子为不饱和碳原子,根据碳的4个价键规则可作如下的断键处理 ( 断键处用虚线表示 )  ,断键后两半键闭合可得由高聚物
,断键后两半键闭合可得由高聚物 的单体为CH3-CH=CH-CN、
的单体为CH3-CH=CH-CN、 和
和 ,故选A.
,故选A.
点评 本题主要考查不饱和烃加聚反应的规律,单体的判断,题目难度不大,本题注意单体与高聚物的判断方法,学习中注意把握方程式的书写.

练习册系列答案
相关题目
3.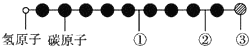 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烷烃 | ||
| C. | ②处的化学键表示碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
8.在乙酸、乙醇和浓硫酸混合物中,加入H218O,过一段时间后,18O还存在于( )
| A. | 乙醇分子中 | B. | 乙酸和乙酸乙酯分子中 | ||
| C. | 乙醇和乙酸乙酯分子中 | D. | 乙酸分子中 |
18.新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti原子的外围电子排布图为 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.
②LiBH4由Li+和BH4-构成.BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3,
BH4-内部含有的微粒间作用力有cd(a.离子键b.非极性键c.极性键d.配位键e.氢键).
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是Mg (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,
H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3
(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti原子的外围电子排布图为
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.②LiBH4由Li+和BH4-构成.BH4-的立体结构是正四面体,B原子的杂化轨道类型是sp3,
BH4-内部含有的微粒间作用力有cd(a.离子键b.非极性键c.极性键d.配位键e.氢键).
Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,
H-的半径为142pm,NaH的理论密度是$\frac{24×4}{{N}_{A}×48{8}^{3}×1{0}^{-30}}$g•cm-3
(只列算式,不必计算出数值,阿伏加德罗常数为NA)
5.已知反应 A+3B?2C+D 在某段时间内以A的浓度变化表示的化学反应速率为0.5mol/(L•s)则此段时间内以B浓度变化表示的化学反应速率( )
| A. | 3 mol/(L•s) | B. | 2mol/(L•s) | C. | 1.5 mol/(L•s) | D. | 0.5mol/(L•s) |
2.下列说法正确的是( )
| A. | 同一原子中,2p、3p、4p能级的轨道数依次增多 | |
| B. | 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则 | |
| C. |  表示的原子能量处于最低状态 表示的原子能量处于最低状态 | |
| D. | 正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族 |


 .
.