题目内容
17.0.48g金属镁与10mL盐酸反应,计算生成的H2在标准状况下的体积(1)缺少的数据是盐酸的物质的量浓度amol•L-1.
(2)计算式(缺少数据用b表示):V(H2)=当c(HCl)≥4mol•L-1时V(H2)=0.448L;当c(HCl)<4mol•L-1时,V(H2)=0.112aL.
分析 (1)不能确定金属是否完全反应,需要知道盐酸的物质的量浓度;
(2)讨论过量问题进行解答,若盐酸足量,Mg完全反应,根据Mg计算氢气体积,若Mg有剩余,盐酸不足,根据盐酸计算氢气的体积,根据Mg与盐酸恰好反应确定盐酸浓度.
解答 解:(1)不能确定金属是否完全反应,需要知道盐酸的物质的量浓度amol•L-1,
故答案为:盐酸的物质的量浓度amol•L-1;
(2)0.48g Mg的物质的量=$\frac{0.48g}{24g/mol}$=0.02mol,由Mg+2HCl=MgCl2+H2↑,可知Mg与HCl恰好时,n(HCl)=0.02mol×2=0.04mol,c(HCl)=$\frac{0.04mol}{0.01L}$=4mol/L,
当c(HCl)≥4mol•L-1时,盐酸足量,Mg完全反应,则n(H2)=n(Mg)=0.02mol,故V(H2)=0.02mol×22.4L/mol=0.448L;
当c(HCl)<4mol•L-1时,Mg有剩余,盐酸不足,n(H2)=$\frac{1}{2}$n(HCl)=0.01L×amol/L=0.005a mol,故V(H2)=0.005 amol×22.4L/mol=0.112 aL,
故答案为:当c(HCl)≥4mol•L-1时V(H2)=0.448L;当c(HCl)<4mol•L-1时,V(H2)=0.112aL.
点评 本题考查化学方程式的有关计算,侧重考查过量计算,难度不大,根据恰好反应确定盐酸的浓度.

练习册系列答案
相关题目
7.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和SiO2 | B. | CO2和HClO | C. | NaCl和HCl | D. | CCl4和KCl |
8.甲醇燃料电池的总反应为:2CH3OH+3O2═2CO2↑+4H2O,如图是该电池的示意图.下列说法正确的是( )

| A. | a 是氧气,b 是甲醇 | |
| B. | 质子从 N 电极区穿过质子交换膜移向 M 电极区 | |
| C. | 正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 当电路中有 3mole-转移时,电池中n(H+)变化为 0 |
5.下列说法中正确的是( )
| A. | NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 | |
| C. | 在同一能级上运动的电子,其运动状态可能相同 | |
| D. | 若ABn的中心原子A上没有未用于形成共价键的孤对电子,当n=3,则分子结构为三角锥形 |
12.由CH4和O2组成的混合气体,标准状况下的密度为1g•L-1,则该混合气体中CH4和O2的体积比为( )
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
2.H2、Cl2、O2组成混合气体,一定条件下恰好完全反应生成盐酸,则原混合气体中,H2、Cl2、O2的物质的量之比正确的是( )
| A. | 3:2:1 | B. | 6:1:2 | C. | 7:1:3 | D. | 7:4:1 |
3.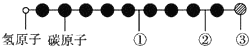 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
 据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )
据报道,近年来发现了一种新的星际分子,其分子模型如下图所示(图中球与球之间的连线表示化学键,如单键、双键或叁键等,颜色相同的球表示同一种原子).下列对该星际分子的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烷烃 | ||
| C. | ②处的化学键表示碳碳单键 | D. | ③处的原子可能是氯原子或氟原子 |
20.下面关于硅的叙述中,正确的是( )
| A. | 硅的化学性质稳定,常温下不与任何物质反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅元素在地壳中的含量居第一位 | |
| C. | 硅在自然界中可以以游离态存在 | |
| D. | 高纯度的单质硅被广泛用于制作计算机芯片 |
 .
.