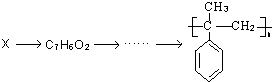
题目内容
填空回答:
(1)氮化硅是一种高温陶瓷材料.根据元素周期律知识,写出氮化硅的化学式: .
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物.回答:
①F元素位于周期表中的位置 .
②E元素的原子结构示意图为 ,B的最高价氧化物的水化物的化学式为 .
③向丙物质中滴加甲的化学反应方程式为 .
(1)氮化硅是一种高温陶瓷材料.根据元素周期律知识,写出氮化硅的化学式:
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
| 形成的化合物 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合物中各元素的原子个数比 | A:C=2:1 | B:A=1:3 | D:C=1:1 | E:F=1:3 | A:F=1:1 |
①F元素位于周期表中的位置
②E元素的原子结构示意图为
③向丙物质中滴加甲的化学反应方程式为
考点:位置结构性质的相互关系应用
专题:
分析:(1)N原子与硅原子通过共价键结合成原子晶体氮化硅,氮显-3价,硅显+4价,正负化合价代数和为0写出化学式;
(2)原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多3个,则B为N元素,A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且它们形成化合物时B:A=1:3,则A为H元素;C原子的最外层电子数是次外层电子数的3倍,则C含有两个电子层,最外层为6个电子,为O元素;D、A同主族,则D处于ⅠA族,原子序数大于N,则D为Na元素;D、E、F同周期,则E、F位于第三周期,E与F的原子序数之和为30,二者按照E:F=1:3形成化合物丁,则E为Al、F为Cl,据此进行解答.
(2)原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多3个,则B为N元素,A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且它们形成化合物时B:A=1:3,则A为H元素;C原子的最外层电子数是次外层电子数的3倍,则C含有两个电子层,最外层为6个电子,为O元素;D、A同主族,则D处于ⅠA族,原子序数大于N,则D为Na元素;D、E、F同周期,则E、F位于第三周期,E与F的原子序数之和为30,二者按照E:F=1:3形成化合物丁,则E为Al、F为Cl,据此进行解答.
解答:
解:(1)氮化硅中氮显-3价,硅显+4价,依据化合价代数和为0,可知氮化硅中氮原子数4个,硅原子数3个,则氮化硅的化学式为:Si3N4,
故答案为:Si3N4;
(2)原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多3个,则B为N元素,A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且它们形成化合物时B:A=1:3,则A为H元素;C原子的最外层电子数是次外层电子数的3倍,则C含有两个电子层,最外层为6个电子,为O元素;D、A同主族,则D处于ⅠA族,原子序数大于N,则D为Na元素;D、E、F同周期,则E、F位于第三周期,E与F的原子序数之和为30,二者按照E:F=1:3形成化合物丁,则E为Al、F为Cl,
①根据分析可知,F为Cl元素,原子序数为17,位于周期表中第三周期ⅤⅡA族,
故答案为:第三周期ⅤⅡA族;
②E为Al元素,原子序数为13,最外层含有3个电子,铝原子结构示意图为: ;
;
B为N元素,其最高价氧化物的水化物为硝酸,硝酸的化学式为:HNO3,
故答案为: ;HNO3;
;HNO3;
③D:C=1:1形成丙,则丙为过氧化钠,A:C=2:1形成甲,则甲为水,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
故答案为:Si3N4;
(2)原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多3个,则B为N元素,A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,且它们形成化合物时B:A=1:3,则A为H元素;C原子的最外层电子数是次外层电子数的3倍,则C含有两个电子层,最外层为6个电子,为O元素;D、A同主族,则D处于ⅠA族,原子序数大于N,则D为Na元素;D、E、F同周期,则E、F位于第三周期,E与F的原子序数之和为30,二者按照E:F=1:3形成化合物丁,则E为Al、F为Cl,
①根据分析可知,F为Cl元素,原子序数为17,位于周期表中第三周期ⅤⅡA族,
故答案为:第三周期ⅤⅡA族;
②E为Al元素,原子序数为13,最外层含有3个电子,铝原子结构示意图为:
 ;
;B为N元素,其最高价氧化物的水化物为硝酸,硝酸的化学式为:HNO3,
故答案为:
 ;HNO3;
;HNO3;③D:C=1:1形成丙,则丙为过氧化钠,A:C=2:1形成甲,则甲为水,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑.
点评:本题考查位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见原子结构、元素周期律内容、元素周期表结构,明确常见化学用语的概念及书写原则.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
氢气在氯气中燃烧产生苍白色火焰,在反应中破坏1mol氢气中的化学键消耗的能量为a KJ,破坏1mol 氯气中的化学键消耗的能量为b KJ,形成1mol氯化氢中的化学键释放的能量为c KJ.下列关系式中正确的是( )
| A、a+b>c |
| B、a+b>2c |
| C、a+b<c |
| D、a+b<2c |
下列电离方程式中,正确的是( )
| A、Ca(OH)2=Ca2++2(OH-) |
| B、FeCl3=Fe2++3Cl- |
| C、Al2(SO4)3=2Al3++3SO42- |
| D、H2SO4=H2++SO42- |
芪三酚(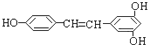 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
 )广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
)广泛存在于食物(如桑葚、花生、葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A、1mol,1mol |
| B、3.5mol,7mol |
| C、5mol,7mol |
| D、6mol,7mol |
 A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题:
A、B、C、D、E、F、G是原子序数依次增大的前四周期的元素,其中A是形成化合物最多的元素之一,并且其常见化合价为+1和-1,B元素基态原子价电子排布式为nsnnpn,D是地壳中含量最大的元素,E的氢氧化物具有两性,F3+的3d能级为半充满,GD是黑色固体,G2D为砖红色固体,回答下列问题: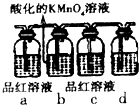 掌握物质之间的转化,是学习元素化合物知识的基础.
掌握物质之间的转化,是学习元素化合物知识的基础.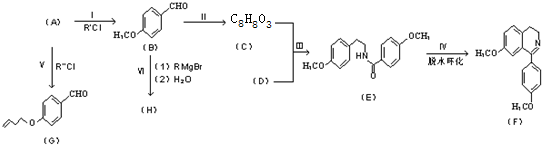
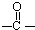 ”结构的物质可发生下列反应:
”结构的物质可发生下列反应: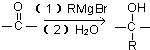
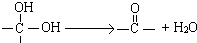
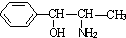 )互为同分异构体
)互为同分异构体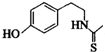 ,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式
,它在一定条件下也能发生类似Ⅳ的环化反应,写出该化合物发生环化反应的化学方程式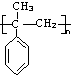 的合成路线流程图:
的合成路线流程图: