题目内容
将不同量的CO(g)和H2O(g)分别加入到体积为2L的恒容密闭容器中,进行反应,得到如下数据
(1)实验1中以v(H2)表示的到达平衡时的平均反应速率为 .
(2)下列图象正确的是 (选填编号).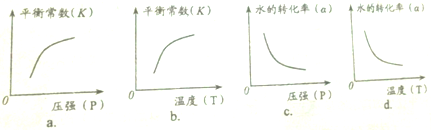
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
| 2 | 800 | 0.02 | 0.03 | 0.017 | 1.6 | 3 |
(2)下列图象正确的是

考点:反应速率的定量表示方法,化学平衡的影响因素
专题:
分析:(1)化学反应速率与化学计量数成正比,先计算出用CO表示的反应速率,然后根据计量数的关系计算出实验1中以v(H2)表示的到达平衡时的平均反应速率;
(2)CO与水的反应为放热反应,升高温度后平衡常数减小,而压强不影响平衡常数.
(2)CO与水的反应为放热反应,升高温度后平衡常数减小,而压强不影响平衡常数.
解答:
解:(1)根据反应方程式CO(g)+H2O(g)?CO2(g)+H2(g)可知,氢气的反应速率与用CO不是的反应速率相等,则实验1中以v(H2)表示的到达平衡时的平均反应速率为:v(H2)=v(CO)=
=0.0016mol/(L?min),
故答案为:0.0016mol/(L?min);
(2)CO(g)+H2O(g)?CO2(g)+H2(g)为放热反应,升高温度后平衡向着逆向移动,化学平衡常数减小,所以b错误、d正确;改变压强后不影响化学平衡常数,故a、c错误;
故答案为:d.
| ||
| 5min |
故答案为:0.0016mol/(L?min);
(2)CO(g)+H2O(g)?CO2(g)+H2(g)为放热反应,升高温度后平衡向着逆向移动,化学平衡常数减小,所以b错误、d正确;改变压强后不影响化学平衡常数,故a、c错误;
故答案为:d.
点评:本题考查了化学反应速率与化学计量数的关系、化学平衡常数及其影响因素,题目难度中等,注意掌握化学反应速率的概念及计算方法,明确化学反应速率与化学计量数的关系.

练习册系列答案
相关题目
今年我国“天宫一号”空间实验室将与“神舟”载人飞船实现对接.飞船升空所需的巨大能量可由下列化学反应提供:C2H3N2+2N2O4=2CO2+3N2+4H2O.有关该反应的说法正确的是( )
| A、是分解反应 |
| B、是氧化还原反应 |
| C、反应中碳元素的化合价降低 |
| D、氧化剂是C2H3N2 |
取100mL 0.3mol/L和300mL 0.25mol/L的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A、0.21 mol/L |
| B、0.42 mol/L |
| C、0.56 mol/L |
| D、0.24 mol/L |
化学用语是学习化学的工具和基础.下列有关化学用语的使用正确的是( )
| A、纯碱溶液呈碱性的原因是:CO32-+2H2O=H2CO3+2OH- | ||||
B、用惰性电极电解MgCl2溶液:Mg2++2Cl-+2H2O
| ||||
| C、乙烯的结构简式:CH2CH2 | ||||
| D、在原电池和电解池中均可发生的电极反应:4OH--4e-=O2↑+2H2O |
下列各组微粒中,互为同位素的是( )
A、
| ||||
| B、H2O和H2O2 | ||||
| C、红磷和白磷 | ||||
| D、甲烷和乙烷 |
下列说法正确的是( )
| A、实验过程中若皮肤不慎沾上少量酸液,应先用大量水冲洗,再用饱和碳酸氢钠溶液洗,最后再用水冲洗 |
| B、用pH试纸测定溶液pH时,通常是将pH试纸放入待测溶液中润湿后,半分钟内跟标准比色卡比较 |
| C、重结晶是提纯固体的常用方法,碘单质亦可在水溶液中通过重结晶提纯 |
| D、用丁达尔现象可鉴别蛋白质溶液、淀粉溶液和葡萄糖溶液 |
