题目内容
下列关于原电池的叙述中,正确的是( )
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:将化学能转变为电能的装置是原电池,原电池中的电极名称是正负极,其电极材料是两种活泼性不同的且导电的物质,且必须能自发的进行氧化还原反应,负极上发生氧化反应,正极上发生还原反应.
解答:
解:A.原电池的两极可能的由导电的非金属组成,如氢氧燃料电池中用石墨作电极材料,故A错误;
B.原电池的负极上失电子发生氧化反应,正极上得电子发生还原反应,故B错误;
C.工作时其负极极不断产生电子并经外电路流向正极,故C错误;
D.原电池能向外提供电能,是将化学能转变为电能的装置,故D正确;
故选D.
B.原电池的负极上失电子发生氧化反应,正极上得电子发生还原反应,故B错误;
C.工作时其负极极不断产生电子并经外电路流向正极,故C错误;
D.原电池能向外提供电能,是将化学能转变为电能的装置,故D正确;
故选D.
点评:本题考查原电池原理,注意原电池的电极材料不一定都是金属,且不一定是较活泼的金属作负极,题目难度不大.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 |
| B、陶瓷、玻璃、水泥容器都能贮存氢氟酸 |
| C、石灰抹墙、水泥砌墙的硬化过程原理相同 |
| D、高纯度的硅广泛用于制作计算机芯片 |
下列叙述正确的是( )
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C、1.0×10-3mol/L盐酸的Ph=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、相同温度下,1 mol?L-1氨水溶液与0.5 mol?L-1氨水溶液中,c(OH-)之比是2:1 |
下列物质中,属于烃的衍生物的是( )
①CH2═CH2 ②CH3CH2OH ③CH3-C≡C-CH3 ④CH3-CH2-C≡CH
⑤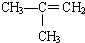 ⑥CaCO3 ⑦
⑥CaCO3 ⑦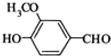 ⑧CH3CH2Br.
⑧CH3CH2Br.
①CH2═CH2 ②CH3CH2OH ③CH3-C≡C-CH3 ④CH3-CH2-C≡CH
⑤
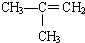 ⑥CaCO3 ⑦
⑥CaCO3 ⑦ ⑧CH3CH2Br.
⑧CH3CH2Br.| A、①③④⑤ | B、⑥⑦⑧ |
| C、②⑦⑧ | D、②⑧ |
下列关于碱金属的叙述正确的是( )
| A、碱金属元素与氧气反应均能形成过氧化物 |
| B、碱金属的密度随着原子序数的递增逐渐减小 |
| C、碱金属元素的最高价氧化物对应的水化物的碱性随着原子序数的递增依次增强 |
| D、碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |
将SO2和SO3两种气体的混合物通入BaCl2溶液,其结果是( )
| A、两种气体都被吸收,并有BaSO4沉淀生成 |
| B、只有BaSO4沉淀,SO2通入溶液中无沉淀生成 |
| C、生成BaSO3和BaSO4两种沉淀 |
| D、只生成BaSO3沉淀,SO3从溶液中逸出 |