题目内容
将SO2和SO3两种气体的混合物通入BaCl2溶液,其结果是( )
| A、两种气体都被吸收,并有BaSO4沉淀生成 |
| B、只有BaSO4沉淀,SO2通入溶液中无沉淀生成 |
| C、生成BaSO3和BaSO4两种沉淀 |
| D、只生成BaSO3沉淀,SO3从溶液中逸出 |
考点:二氧化硫的化学性质
专题:氧族元素
分析:将SO2和SO3两种气体的混合物通入BaCl2溶液,盐酸的酸性大于亚硫酸,二氧化硫不反应,但硫酸钡不溶于酸,以此来解答.
解答:
解:将SO2和SO3两种气体的混合物通入BaCl2溶液,盐酸的酸性大于亚硫酸,则二氧化硫不反应,但硫酸钡不溶于酸,可发生三氧化硫与氯化钡的反应生成硫酸钡沉淀,故选B.
点评:本题考查二氧化硫的化学性质,为高频考点,把握酸性的比较及硫酸钡不溶于酸为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
下列反应中,属于加成反应的是( )
| A、苯酚与饱和溴水反应生成三溴苯酚 |
| B、乙酸与乙醇反应制取乙酸乙酯 |
| C、甲烷与氯气反应制取一氯甲烷 |
| D、乙烯与氯化氢反应制取氯乙烷 |
下列关于原电池的叙述中,正确的是( )
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |
有一未知浓度的硫酸溶液25mL,在加入0.1mol/L BaCl2溶液10mL后,改加NaOH溶液,结果用去0.1mol/L NaOH溶液25mL恰好完全中和,则此硫酸的物质的量浓度为( )
| A、0.2 mol/L |
| B、0.5 mol/L |
| C、0.1 mol/L |
| D、0.05 mol/L |
下列离子组一定能大量共存的是( )
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | ||
B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HC
| ||
| C、pH=13的溶液中:K+、Na+、NO3-、ClO- | ||
| D、氯化铝溶液中Na+、AlO2-、NO3-、HCO3- |
下列说法正确的是( )
| A、氟氯烃是一类含氟和氯原子的卤代烃 |
| B、1-丁烯存在顺反异构 |
| C、1mol甲烷可与2mol Cl2完全取代生成CCl4 |
D、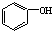 的结构中含有决定醇类性质的官能团--羟基 的结构中含有决定醇类性质的官能团--羟基 |
工业上用碳在高温下还原SiO2制取硅,如果将30g SiO2和足量的碳在高温下充分反应,则下列叙述中正确的是( )
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
无论是在水溶液中还是在熔融状态下均不导电的化合物为非电解质.下列各组物质中,前者属于电解质,后者属于非电解质的是( )
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |