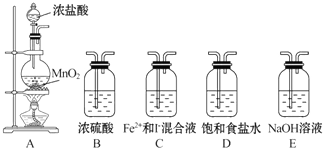
题目内容
用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸.
(1)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(2)经计算,上述浓硫酸的浓度为 mol/L.配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为 mL(保留一位小数),量取时应选用 (填序号①10mL、②50mL、③100mL)规格的量筒.
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入 mL的容量瓶中,并将洗涤液移入容量瓶中.
b.向容量瓶内加水,直到液面接近刻度线 cm时,改用 小心地加水至溶液凹液面与刻度线相切.
c.将容量瓶盖好瓶盖,摇匀.
(4)配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果 ;
所用容量瓶未干燥,则结果 ;
定容时俯视,则结果 .
(1)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀.
(2)经计算,上述浓硫酸的浓度为
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入
b.向容量瓶内加水,直到液面接近刻度线
c.将容量瓶盖好瓶盖,摇匀.
(4)配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果
所用容量瓶未干燥,则结果
定容时俯视,则结果
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据容量瓶的构造及正确使用方法进行判断;
(2)根据c=
计算出该浓硫酸的物质的量浓度;再根据浓硫酸在稀释过程中溶质的物质的量不变计算出需要浓硫酸的体积;根据计算结果判断量筒的规格;
(3)根据配制一定物质的量浓度的溶液的正确操作方法进行解答;
(4)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据c=
| 1000ρw |
| M |
(3)根据配制一定物质的量浓度的溶液的正确操作方法进行解答;
(4)根据c=
| n |
| V |
解答:
解:(1)A.使用容量瓶前检查其是否漏水,否则配制溶液的浓度有误差,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,配制溶液的浓度偏高,故B错误;
C.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中溶解溶质,故C错误;
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,用胶头滴管滴加蒸馏水到刻度线,容量瓶不能稀释溶液,故D错误;
E.盖好瓶盖,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,目的是摇匀溶液,故E正确;
故答案为:BCD;
(2)1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为:c=
mol/L=18.4mol/L;配制100mL 1.00mol/L 的稀硫酸,配制过程中硫酸的物质的量不变,则需要浓硫酸的体积为:
≈0.054L=5.4mL;需要使用10mL量筒量取5.4mL浓硫酸,所以①正确,
故答案为:18.4;5.4;①;
(3)a.配制100mL溶液,需要选用100mL容量瓶;
b.定容时,先直接加水至容量瓶刻度线1~2cm,然后改用胶头滴管小心定容,
故答案为:100;1~2;胶头滴管;
(4)转移时未洗涤烧杯,导致配制的溶液中溶质的物质的量偏小,则配制结果偏低;
所用容量瓶未干燥,对溶质的物质的量及溶液的体积都无影响,所以配制的溶液浓度不变;
定容时俯视,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏低;不变;偏高.
B.容量瓶用蒸馏水洗净后,再用待配溶液洗涤,导致溶质的物质的量偏大,配制溶液的浓度偏高,故B错误;
C.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中溶解溶质,故C错误;
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,用胶头滴管滴加蒸馏水到刻度线,容量瓶不能稀释溶液,故D错误;
E.盖好瓶盖,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,目的是摇匀溶液,故E正确;
故答案为:BCD;
(2)1.84g/cm3、质量分数为98%的浓硫酸的物质的量浓度为:c=
| 1000×1.84×98% |
| 98 |
| 1.00mol/L×0.1L |
| 18.4mol/L |
故答案为:18.4;5.4;①;
(3)a.配制100mL溶液,需要选用100mL容量瓶;
b.定容时,先直接加水至容量瓶刻度线1~2cm,然后改用胶头滴管小心定容,
故答案为:100;1~2;胶头滴管;
(4)转移时未洗涤烧杯,导致配制的溶液中溶质的物质的量偏小,则配制结果偏低;
所用容量瓶未干燥,对溶质的物质的量及溶液的体积都无影响,所以配制的溶液浓度不变;
定容时俯视,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液的浓度偏高,
故答案为:偏低;不变;偏高.
点评:本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度中等,注意掌握配制一定物质的量浓度的溶液的方法,明确误差分析的方法与技巧,试题有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
下列关于原电池的叙述中,正确的是( )
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |
工业上用碳在高温下还原SiO2制取硅,如果将30g SiO2和足量的碳在高温下充分反应,则下列叙述中正确的是( )
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
无论是在水溶液中还是在熔融状态下均不导电的化合物为非电解质.下列各组物质中,前者属于电解质,后者属于非电解质的是( )
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |
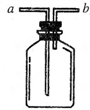 (1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是
(1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是