题目内容
16.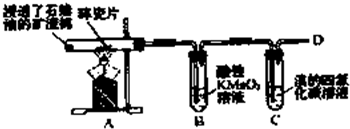 乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.
乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.(1)A中碎瓷片的作用是催化作用.
(2)B中反应类型是氧化反应,C中实验现象是溴的四氯化碳溶液褪色.
分析 (1)碎瓷片有催化作用;
(2)乙烯含有碳碳双键,能被酸性高锰酸钾氧化;乙烯能和溴发生加成反应.
解答 解:(1)由题意:石蜡油在炽热碎瓷片的作用下产生乙烯,可知其作用主要是催化剂,加快反应速率,故答案为:催化作用;
(2)乙烯可以被KMnO4氧化,生成CO2,发生的是氧化反应;乙烯中含有一个碳碳双键,可以和溴发生加成反应,使溴的四氯化碳溶液褪色,
故答案为:氧化反应;溴的四氯化碳溶液褪色.
点评 本题考查了乙烯的化学性质,题目难度不大,要注意乙烯中含有碳碳双键,有还原性,能使高锰酸钾溶液和溴水褪色,但是反应类型不同.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
6.对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol•L-1,则理论上最多能溶解铜的物质的量为( )
| A. | 0.80 mol | B. | 0.72 mol | C. | 0.45 mol | D. | 0.40 mol |
7.某烃的结构简式是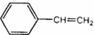 ,它不可能具有的性质是( )
,它不可能具有的性质是( )
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )| A. | 既能使溴水褪色,也能使酸性KMnO4溶液褪色 | |
| B. | 易溶于水和有机溶剂 | |
| C. | 能与H2在一定条件下发生反应 | |
| D. | 能发生加聚反应,生成物可用 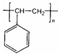 表示 表示 |
4.下列有关SO2和CO2的说法正确的是( )
| A. | 都是非极性分子 | B. | 中心原子都采取sp杂化 | ||
| C. | S原子和C原子都没有孤对电子 | D. | SO2为V形结构,CO2为直线形结构 |
1.下列数据是对应物质的熔点,有关的判断错误的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A. | 含有金属阳离子的晶体不一定是离子晶体 | |
| B. | 同族元素的氧化物可形成不同类型的晶体 | |
| C. | 活泼金属元素与活泼非金属元素一定能形成离子化合物 | |
| D. | 金属晶体的熔点不一定比分子晶体的高 |
8. 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
 向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )
向表的甲物质中逐滴加入乙溶液至过量,反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用下图表示的是( )| 序号 | 甲 | 乙 |
| A | 镁条 | 稀硫酸 |
| B | 硫酸铁溶液 | 氢氧化钠溶液 |
| C | 硝酸钡溶液 | 硫酸钠溶液 |
| D | 生锈的铁钉 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
7.A、B两元素位于短周期,A原子半径小于B原子半径,两元素可形成A是正价的AB2化合物,下列有关A、B两元素的叙述中正确的是( )
| A. | A、B可能属同一周期 | |
| B. | A位于B的前一周期 | |
| C. | A只能是金属元素 | |
| D. | A可能是第二周期的ⅡA族或ⅣA族元素 |
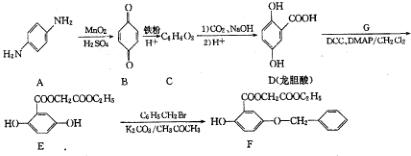
 ;
; ;
;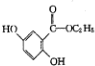 )的一种同分异构体的结构简式
)的一种同分异构体的结构简式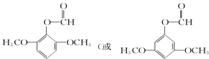 ;
;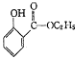 )的合成路线流程图(无机试剂任用),相关信息:
)的合成路线流程图(无机试剂任用),相关信息: .
.
