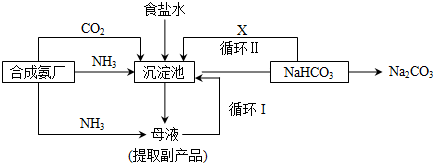
题目内容
5.某实验小组同学进行如下实验,以探究化学反应中的能量变化.
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是吸热(填“吸热”或“放热”)反应.
(2)实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,如图A所示,该反应是放热(填“吸热”或“放热”)反应,其能量变化可用下图中的B(填“B”或“C”)表示.

图A中0一tl段化学反应速率变化的原因是温度升高,反应的速率加快.
分析 (1)温度升高,则反应放热;温度降低则反应吸热;
(2)浓度越小,反应速率越小,温度越高,速率越大;放热反应中,反应物的总能量大于生成物的总能量,吸热反应中,反应物的总能量小于生成物的总能量;根据金属与酸的反应为放热反应分析.
解答 解:(1)①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是吸热反应,故答案为:吸热;
(2)在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,观察产生H2的速率,开始时盐酸的浓度减小,速率应减小,但实际上增大,说明温度对速率的影响大于浓度对速率的影响,则该反应放热;放热反应中,反应物的总能量大于生成物的总能量;金属与酸的反应为放热反应,温度影响反应的速率,温度越高,反应的速率越快;
故答案为:放热;B;温度升高,反应的速率加快.
点评 此题是一道实验探究题,解题的关键是分析实验的过程,并结合题中所给的信息结合所学相关知识对问题进行探讨与分析.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | 向CuSO4溶液中加入钠:2Na+Cu2+=Cu+2Na+ | |
| B. | 向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-=2H2O+BaCl2 | |
| C. | 澄清石灰水与盐酸反应:H++OH-=H2O | |
| D. | Na2O2与水发生反应:2O22-+2 H2O=4 OH-+O2↑ |
20.某有机物11.0克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与26.4克,该有机物可能是( )
| A. | CH4 | B. | C2H6 | C. | C6H6 | D. | C6H6O2 |
10.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火馅皆呈黄色,但生成固体的颜色不同 | |
| B. | 新制饱和氯水和浓硝酸在光照下会有气体产生,其成分中有氧气 | |
| C. | 亚硫酸露置在空气中酸性减弱 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应 |
16.下列各组离子一定能大量共存的是( )
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| C. | 加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+ | |
| D. | 滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42- |
 、
、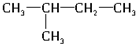 .
.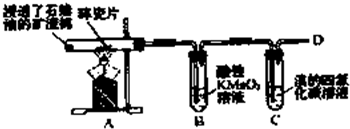 乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.
乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题.