题目内容
11.下列反应的离子方程式正确的是( )| A. | 铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铁粉加入三氯化铁溶液中:2Fe+Fe3+=3Fe2+ | |
| C. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O | |
| D. | FeCl2溶液中加入氯水:Cl2+2 Fe2+=2 Fe3++2Cl- |
分析 A.漏写氧化剂水;
B.电子、电荷不守恒;
C.一水合氨在离子反应中保留化学式;
D.反应生成氯化铁,遵循电子、电荷守恒.
解答 解:A.铝粉投入到NaOH溶液中的离子反应为2Al+2H2O+2OH-=2AlO2-+3H2↑,故A错误;
B.铁粉加入三氯化铁溶液中的离子反应为Fe+2Fe3+=3Fe2+,故B错误;
C.AlCl3溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.FeCl2溶液中加入氯水的离子反应为Cl2+2Fe2+=2Fe3++2Cl-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.同周期元素X、Y、Z,其最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 酸性:HXO4<H2Y O4<H3ZO4 | B. | 气态氢化物的稳定性:X<Y<Z | ||
| C. | 非金属性:X>Y>Z | D. | 元素负化合价的绝对值:X>Y>Z |
2.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 合成氨工业常采用Pt~Rh合金作为催化剂 | |
| D. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 |
19.对反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2△H3=-260.2 kJ•mol-1处于化学平衡状态时的描述,不正确的是( )
| A. | CO的含量保持不变 | |
| B. | 容器中CH3OCH3浓度与CO2浓度可能相同 | |
| C. | 3V正(CO)=V正(CH3OCH3) | |
| D. | 体系的温度保持不变 |
6.1mol某金属单质与足量的盐酸反应,放出11.2L H2(标准状况),并转变为与Ne原子电子层结构相同的离子,该金属元素在元素周期表中的位置是( )
| A. | 第三周期第IA族 | B. | 第四周期第IA族 | C. | 第三周期第ⅡA族 | D. | 第四周期第ⅡA族 |
16.下列因果关系成立的是( )
| A. | 因为SiO2能与强碱溶液反应,所以盛装强碱溶液的试剂瓶不用玻璃塞 | |
| B. | 因为SO2可以使溴水褪色,所以SO2具有漂白性 | |
| C. | 因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH | |
| D. | 因为NH3的水溶液可以导电,所以NH3是电解质 |
20.X、Y、Z、M是元素周期表中的短周期主族元素,且原子序数依次增大.X原子最外层电子数是内层电子数的2倍,Y、M同主族且M的核电荷数是Y的2倍,Z原子的半径在同周期主族元素原子中最大.下列有关说法正确的是( )
| A. | 气态氢化物的稳定性:X>Y | |
| B. | Y和M元素的最高正价相同 | |
| C. | X、Z分别与Y形成的化合物中,化学键类型相同 | |
| D. | Z的最高氧化物的水化物是强碱 |
1.已知a、b、c、d、e是短周期中原子序数依次增大的5种主族元素,其中元素a、e的单质在常温下呈气态,元素b的原子最外层电子数是其电子层数的2倍,元素c在同周期的主族元素中原子半径最大,元素d的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 原子半径:b<c<d | |
| B. | 金属性:d>c | |
| C. | 化合物ae与ce含有的化学键类型相同 | |
| D. | c、d的最高价氧化物对应的水化物之间能发生反应 |
 ,B的结构式为
,B的结构式为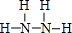 .
.