题目内容
短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成DB2、DB3两种分子,DB2具有漂白性.
回答下列问题:
(1)A的氢化物的电子式是
(2)下列叙述中,正确的是 (填字母)
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2->D2-
C.酸性:H4CO4>H2DO4 d.最高化合价值:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
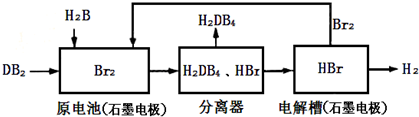
①试写出原电池中发生反应的离子方程式:
②根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好.
③在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”).
④将该工艺流程用总反应的化学方程式表示为: .该生产工艺的优点有 (答一点即可);缺点有 (答一点即可).
| A | B | |
| C | D |
(1)A的氢化物的电子式是
(2)下列叙述中,正确的是
a.稳定性:A的氢化物>C的氢化物 b.还原性:B2->D2-
C.酸性:H4CO4>H2DO4 d.最高化合价值:D=B>A>C
(3)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.

①试写出原电池中发生反应的离子方程式:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到
③在电解过程中,电解槽阴极附近溶液pH
④将该工艺流程用总反应的化学方程式表示为:
考点:元素周期律和元素周期表的综合应用,元素周期律的作用,原电池和电解池的工作原理,电解原理
专题:元素周期律与元素周期表专题,电化学专题
分析:由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D同主族,B、D最外层电子数之和为12,故最外层电子数为6,故B为O元素,D为S元素,二者可以形成SO2、SO3两种分子,且SO2具有漂白性,由位置关系可知,A为N元素,C为Si元素,
(1)A的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(2)a.非金属性越强,氢化物越稳定;
b.非金属性越强,阴离子还原性越弱;
C.非金属性越强,最高价含氧酸的酸性越强;
d.O元素没有最高正化合价;
(3)①由工艺流程图可知,原电池中是SO2、Br2、H2O反应生成H2SO4、HBr;
②分离完全,硫酸中不含HBr,加入AgNO3溶液,根据沉淀颜色判断;
③在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低;
④原电池中电池总反应为:SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,两式相加可得该工艺流程用总反应的化学方程式;
该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大.
(1)A的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(2)a.非金属性越强,氢化物越稳定;
b.非金属性越强,阴离子还原性越弱;
C.非金属性越强,最高价含氧酸的酸性越强;
d.O元素没有最高正化合价;
(3)①由工艺流程图可知,原电池中是SO2、Br2、H2O反应生成H2SO4、HBr;
②分离完全,硫酸中不含HBr,加入AgNO3溶液,根据沉淀颜色判断;
③在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低;
④原电池中电池总反应为:SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,两式相加可得该工艺流程用总反应的化学方程式;
该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大.
解答:
解:由短周期元素A、B、C、D在周期表中的位置可知,A、B处于第二周期,C、D处于第三周期,B、D同主族,B、D最外层电子数之和为12,故最外层电子数为6,故B为O元素,D为S元素,二者可以形成SO2、SO3两种分子,且SO2具有漂白性,由位置关系可知,A为N元素,C为Si元素,
(1)A为N元素,其氢化物为NH3,N原子与H原子之间形成1对共用电子对,电子式为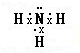 ,
,
故答案为: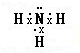 ;
;
(2)a.非金属性N>Si,故氢化物稳定性NH3>SiH4,故a正确;
b.非金属性O>S,非金属性越强,阴离子的还原性越弱,故还原性O2-<S2-,故b错误;
c.非金属性S>Si,故酸性:H4SiO4<H2SO4,故c错误;
d.氧元素一般没有正化合价,故d错误;
故答案为:a;
(3)①由工艺流程图可知,原电池中是SO2、Br2、H2O反应生成H2SO4、HBr,反应的离子方程式:SO2+Br2+2H2O=SO42-+4H++2Br-,
故答案为:SO2+Br2+2H2O=SO42-+4H++2Br-;
②取分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
④原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2,
该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大,
故答案为:SO2+2H2O=H2SO4+H2;溴可以循环利用,获得清洁能源氢气;生成过程有有毒物质,电解循环消耗能源大.
(1)A为N元素,其氢化物为NH3,N原子与H原子之间形成1对共用电子对,电子式为
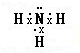 ,
,故答案为:
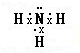 ;
;(2)a.非金属性N>Si,故氢化物稳定性NH3>SiH4,故a正确;
b.非金属性O>S,非金属性越强,阴离子的还原性越弱,故还原性O2-<S2-,故b错误;
c.非金属性S>Si,故酸性:H4SiO4<H2SO4,故c错误;
d.氧元素一般没有正化合价,故d错误;
故答案为:a;
(3)①由工艺流程图可知,原电池中是SO2、Br2、H2O反应生成H2SO4、HBr,反应的离子方程式:SO2+Br2+2H2O=SO42-+4H++2Br-,
故答案为:SO2+Br2+2H2O=SO42-+4H++2Br-;
②取分离后的H2SO4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,说明分离效果较好,
故答案为:无淡黄色沉淀产生,最终生成白色沉淀;
③在电解过程中,电解槽阴极发生还原反应,电极反应式为2H++2e-=H2↑,氢离子浓度降低,溶液pH变大,
故答案为:变大;
④原电池中电池总反应为SO2+Br2+2H2O=H2SO4+2HBr,电解池中总反应为2HBr=H2+Br2,故该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2SO4+H2,
该生产工艺的优点:溴可以循环利用,获得清洁能源氢气,缺点是:生成过程有有毒物质,电解循环消耗能源大,
故答案为:SO2+2H2O=H2SO4+H2;溴可以循环利用,获得清洁能源氢气;生成过程有有毒物质,电解循环消耗能源大.
点评:本题考查电子式书写、原电池及电解池原理、元素化合物性质、化学工艺流程等,题目综合性较大,难度中等,是对知识的综合考查,注意基础知识的全面掌握.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)?CO2(g) 十 H2 (g);△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)?CO2(g) 十 H2 (g);△H<0 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.