题目内容
 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.(1)在固定容积的密闭容器中,反应A(g)+2B(g)?4C(g),△H>0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是
A.增加B的物质的量 B.加压 C.升温 D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH)
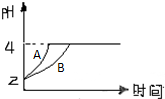
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
考点:化学平衡的影响因素,酸碱混合时的定性判断及有关ph的计算
专题:化学平衡专题,电离平衡与溶液的pH专题
分析:(1)改变条件重新达到平衡后体系中A的转化率增大,可使平衡正向移动分析;
(2)由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,浓度相同时溶液显碱性,则酸的浓度大,依据溶液中电荷守恒分析判断离子浓度大小;
(3)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答.
(2)由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,浓度相同时溶液显碱性,则酸的浓度大,依据溶液中电荷守恒分析判断离子浓度大小;
(3)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答.
解答:
解:(1)若改变条件重新达到平衡后体系中A的转化率增大,可使平衡正向移动,
A、增加B的物质的量,平衡向正反应方向移动,A的转化率增大,故A正确;
B、加压,平衡向逆反应方向移动,A的转化率增大,故B错误;
C、升温,平衡向正反应方向移动,A的转化率增大,故C正确;
④使用催化剂,平衡不移动,A的转化率不变,故D错误;
故选AC;
(2)由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,浓度相同时溶液显碱性,则酸的浓度大,即c(NaOH)<c(CH3COOH),溶液中存在的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),混合而且恰好呈中性c(H+)=c(OH-),c(CH3COO-)=(Na+),
故答案为:<;=;
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2,
故答案为:B;<.
A、增加B的物质的量,平衡向正反应方向移动,A的转化率增大,故A正确;
B、加压,平衡向逆反应方向移动,A的转化率增大,故B错误;
C、升温,平衡向正反应方向移动,A的转化率增大,故C正确;
④使用催化剂,平衡不移动,A的转化率不变,故D错误;
故选AC;
(2)由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,浓度相同时溶液显碱性,则酸的浓度大,即c(NaOH)<c(CH3COOH),溶液中存在的电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),混合而且恰好呈中性c(H+)=c(OH-),c(CH3COO-)=(Na+),
故答案为:<;=;
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2,
故答案为:B;<.
点评:本题考查弱电解质的电离,化学平衡影响因素分析判断,侧重于学生的分析能力的考查,为高考常见题型和高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性,注意把握弱电解质的电离特点和影响因素,平衡移动原理实质理解应用,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能.所用的原料仍然是Pb-PbO2-H2SO4,下列关于该铅酸蓄电池的说法正确的是( )
| A、充电时,电源的正极接蓄电池标“+”的一极,电池上标有“-”的一极发生氧化反应 |
| B、“无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
| C、放电时,在铅酸蓄电池的负极发生还原反应 |
| D、若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
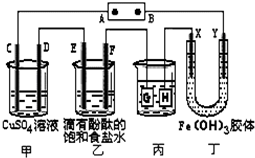 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.