题目内容
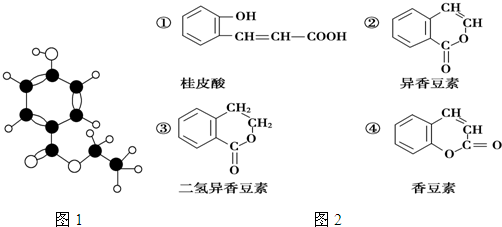
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)写出①、④两种元素的名称 , .
(2)写出⑤、⑨两种元素的符号 , .
(3)画出⑥的离子结构示意图 ,画出⑦的原子结构示意图 .
(4)④、⑤、⑥的原子半径由大到小的顺序为 .
(5)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(6)写出由①、④、⑤三种元素组成化合物的电子式: .
(7)写出②元素最高价氧化物的电子式 ,③元素的氢化物的结构式为 .
(8)用电子式表示⑤元素和⑧元素形成的化合物的形成过程 .
(9)写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式 .
(10)写出单质②与⑧的最高价氧化物对应的水化物浓溶液反应的化学方程式 .
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)写出⑤、⑨两种元素的符号
(3)画出⑥的离子结构示意图
(4)④、⑤、⑥的原子半径由大到小的顺序为
(5)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(6)写出由①、④、⑤三种元素组成化合物的电子式:
(7)写出②元素最高价氧化物的电子式
(8)用电子式表示⑤元素和⑧元素形成的化合物的形成过程
(9)写出⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式
(10)写出单质②与⑧的最高价氧化物对应的水化物浓溶液反应的化学方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)(2)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl;
(3)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8;
Si原子核外电子数为14,有,3个电子层,各层电子数为2、8、4;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(5)非金属性越强,最高价含氧酸的酸性越强;
(6)①、④、⑤三种元素组成化合物为NaOH,由钠离子与氢氧根离子构成;
(7)②元素最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对;③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(8)⑤元素和⑧元素形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(9)⑥的最高价氧化物为氧化铝,⑤的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水;
(10)碳与浓硫酸在加热条件下生成二氧化碳、二氧化硫与水.
(3)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8;
Si原子核外电子数为14,有,3个电子层,各层电子数为2、8、4;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(5)非金属性越强,最高价含氧酸的酸性越强;
(6)①、④、⑤三种元素组成化合物为NaOH,由钠离子与氢氧根离子构成;
(7)②元素最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对;③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(8)⑤元素和⑧元素形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(9)⑥的最高价氧化物为氧化铝,⑤的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水;
(10)碳与浓硫酸在加热条件下生成二氧化碳、二氧化硫与水.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl.
(1)①、④两种元素的名称分别为氢、氧,故答案为:氢;氧;
(2)⑤、⑨两种元素的符号 分别为Na、Cl,故答案为:Na;Cl;
(3)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为 ;
;
Si原子核外电子数为14,有,3个电子层,各层电子数为2、8、4,原子结构示意图为 ,
,
故答案为: ;
; ;
;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(5)非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(6)①、④、⑤三种元素组成化合物为NaOH,由钠离子与氢氧根离子构成,其电子式为 ,故答案为:
,故答案为: ;
;
(7)②元素最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,电子式为 ;③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,结构式为:
;③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,结构式为: ,故答案为:
,故答案为: ;
; ;
;
(8)⑤元素和⑧元素形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为: ,
,
故答案为: ;
;
(9)⑥的最高价氧化物为氧化铝,⑤的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(10)碳与浓硫酸在加热条件下生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O.
(1)①、④两种元素的名称分别为氢、氧,故答案为:氢;氧;
(2)⑤、⑨两种元素的符号 分别为Na、Cl,故答案为:Na;Cl;
(3)Al3+离子核电荷数为13,核外电子数为10,有2个电子层,各层电子数为2、8,离子结构示意图为
 ;
;Si原子核外电子数为14,有,3个电子层,各层电子数为2、8、4,原子结构示意图为
 ,
,故答案为:
 ;
; ;
;(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,故答案为:Na>Al>O;
(5)非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(6)①、④、⑤三种元素组成化合物为NaOH,由钠离子与氢氧根离子构成,其电子式为
 ,故答案为:
,故答案为: ;
;(7)②元素最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,电子式为
 ;③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,结构式为:
;③元素的氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,结构式为: ,故答案为:
,故答案为: ;
; ;
;(8)⑤元素和⑧元素形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成过程为:
 ,
,故答案为:
 ;
;(9)⑥的最高价氧化物为氧化铝,⑤的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(10)碳与浓硫酸在加热条件下生成二氧化碳、二氧化硫与水,反应方程式为:C+2H2SO4(浓)
| ||
| ||
点评:本题考查元素周期表与元素周期律综合应用,难度不大,侧重对化学用语的考查,注意对基础知识的理解掌握.

练习册系列答案
相关题目
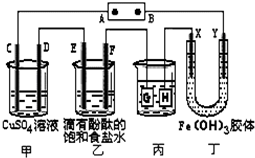 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
 (3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是
(3)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题:
实际上电离平衡、盐的水解平衡等,它们都可看作是化学平衡的一种.请根据所学化学知识回答下列问题: