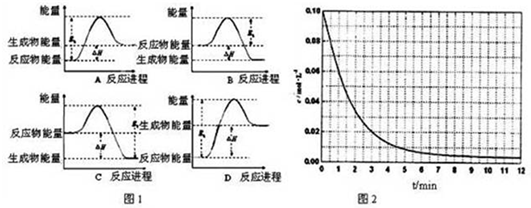
题目内容
13.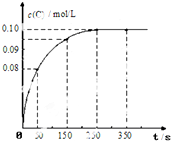 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在0~50s的平均速率v(C)=1.6×10-3mol/(L•s) | |
| B. | 该温度下,反应的平衡常数K=0.025 | |
| C. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 | |
| D. | 反应达平衡后,再向容器中充入 1 mol A,该温度下再达到平衡时0.1mol/L<c(C)<0.2mol/L |
分析 A.由图可知,0~50s 内C的浓度变化量为0.08mol/L,根据v=$\frac{△c}{△t}$计算v(C);
B.由图可知,250s时达到平衡,平衡时c(C)=0.1mol/L,利用三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
C.计算温度为T平衡时c(A),根据升高温PCl3浓度的变化,判断平衡移动方向,据此解答;
D.反应达平衡后,再向容器中充入 1mol A,等效为增大压强,与原平衡相比A转化率降低,据此解答.
解答 解:A.由图可知,0~50s 内C的浓度变化量为0.08mol/L,故v(C)=$\frac{0.08mol/L}{50s}$=1.6×10-3mol/(L•s),故A正确;
B.由图可知,250s时达到平衡,平衡时c(C)=0.1mol/L,则:
A(g)?B(g)+C(g)
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
故该温度下平衡常数为:K=$\frac{0.1×0.1}{0.4}$=0.025,故B正确;
C.由B可知,平衡时c(A)=0.1mol/L,保持其他条件不变,升高温度,平衡时c′(A)=0.11mol/L,浓度增大,平衡向正反应移动,故该反应正反应为吸热反应,即△H>0,故C错误;
D.反应达平衡后,再向容器中充入 1mol A,平衡向正反应移动,增大压强,与原平衡相比A转化率降低,故达平衡时0.1mol/L<c(C)<0.2mol/L,故D正确;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学平衡图象、化学反应速率计算、平衡常数计算、化学平衡影响因素等知识,注意D选项可以根据平衡常数计算氯气浓度的具体值.

| A. | HCl | B. | Na2O | C. | NaCl | D. | FeCl2 |
| A. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| B. | 热化学方程式中,如果没有注明温度和压强则表示在标准状况下测得的数据 | |
| C. | 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态 | |
| D. | 1mol碳燃烧所放出的热量为燃烧热,1mol强酸和1mol强碱完全反应所放出的热称为中和热 |
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度、溶度积KSP均不变 | ||
| C. | AgCl的溶度积KSP增大 | D. | AgCl的溶解度、溶度积KSP均增大 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
(1)写出该反应的化学平衡常数表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,a小于(填“大于”、“小于”或“等于”)0.
(2)200℃时,向此密闭容器中充入0.20mol的N2和0.80mol的H2,反应初始6s内达到了平衡状态,N2的平均反应速率v(N2)=0.03mol•L-1•s-1.则6s时NH3的物质的量为0.18mol,c(N2)=0.22mol•L-1;此时N2的转化率为45%,如果这时向该密闭容器中再充入1mol氩气,N2的转化率不变(填“增大”“不变”“减小”).
(3)400℃时,2NH3(g)?N2(g)+3H2(g)的化学平衡常数为2,测得氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,该反应的v正(N2)大于(填“大于”、“小于”或“等于”)v逆(N2).
| A. | 分散系的分类: | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 如图显示的是树林的晨曦,该现象与丁达尔效应有关 | |
| D. | 在Fe(OH)3胶体中加入过量硫酸后会出现红褐色沉淀 |