题目内容
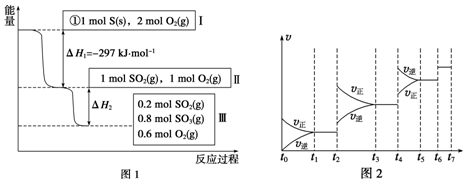
4.研究CO、NO2、SO2等大气污染气体的处理具有重要意义.(1)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
2I2(s)+5O2(g)=2I2O5(s)△H=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol.
(2)已知反应:NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=$\frac{8}{3}$.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为放热反应.(填“放热”或“吸热”)
②该反应的焓变为△H,活化能为E0,下列能量关系图(图1)合理的是B.
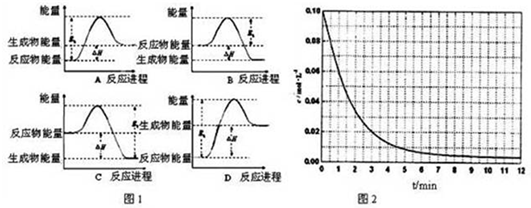
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH3OH浓度随时间的变化曲线.
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;根据三行式以及化学平衡常数表达式计算化学平衡常数;
(3)①依据平衡常数随温度变化,平衡常数越大,平衡正向进行,温度越高平衡向吸热反应方向进行;
②分析判断反应是放热反应,反应物能量高于生成物,焓变是反应物和生成物之间的能量差值与变化过程无关;
(4)某温度时,根据H2浓度随时间的变化曲线,氢气浓度减小到平衡不变,甲醇浓度增大到平衡不变,依据物质的量的变化绘出CH2OH浓度随时间的变化曲线.
解答 解:(1)2 I2(s)+5O2(g)=2 I2O5(s);△H=-75.56kJ•mol-1①,
2CO(g)+O2(g)=2 CO2(g);△H=-566.0kJ•mol-1②,
将方程式②×$\frac{5}{2}$-①×$\frac{1}{2}$得5CO(g)+I2O5(s)=5 CO2(g)+I2(s);△H=(-566.0kJ•mol-1)×$\frac{5}{2}$-(-75.56kJ•mol-1)×$\frac{1}{2}$=-1377.22kJ/mol,
所以其热化学反应方程式为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol,
故答案为:5CO(g)+I2O5(s)=5 CO2(g)+I2(s)△H=-1377.22kJ/mol;
(2)本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据,故选b;
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
则(a-x):(2a-x)=1:6,故x=$\frac{4}{5}$a,故平衡常数为=$\frac{{x}^{2}}{(a-x)(2a-x)}$=$\frac{8}{3}$.
故答案为:b;$\frac{8}{3}$;
(3)反应方程式为CO(g)+2H2(g)?CH3OH(g)
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,说明温度升高平衡常数减小,平衡逆向进行,正反应是放热反应;
故答案为:放热;
②反应是放热反应,反应物能量高于生成物,焓变是反应物和生成物之间的能量差值;
A、反应物能量低于生成物反应是吸热反应,故A错误;
B、反应物能量高于生成物是放热反应,焓变符合,活化能是正反应的活化能,故B正确;
C、反应物能量高于生成物是放热反应,焓变符合,活化能不是正反应的活化能,故C错误;
D、反应物能量低于生成物反应是吸热反应,故D错误;
故答案为:B;
(4)某温度时,根据图象中的H2浓度随时间的变化曲线,氢气浓度减小到平衡不变,甲醇浓度增大到平衡不变,依据氢气的浓度和化学方程式计算甲醇浓度的增加描点画出图象,(0.01,0.02)(0.02,0.04)(0.03,0.06),(0.04,0.08)绘出CH2OH浓度随时间的变化曲线为: ;故答案为:
;故答案为: .
.
点评 本题考查了热化学方程式和盖斯定律计算应用,化学平衡影响因素的分析判断,化学平衡的计算应用,图象分析绘制,题目难度中等.

下面是关于四氟乙烯的几种说法:
①它是由碳、氟两种元素组成的化合物,
②它是由氟气(分子式为:F2)和碳组成的化合物
③它的分子中碳、氟两种元素的原子物质的量比为1:2
这些说法中正确的是( )
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1(填“>”、“<”或“=”).

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol
副反应有:CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=a kJ/mol
CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=b kJ/mol
CH4(g)+O2(g)?HCHO(g)+H2O(g)△H=c kJ/mol
甲醇与氧气反应生成HCHO(g)和水蒸汽的热化学方程式为CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1.
(2)苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g)?C8H8(g)+H2(g)△H>0.T1℃下,将0.40mol苯乙烷充入2L密闭容器中反应,不同时间容器内n(C8H10)如表:
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
②改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为40%.
(3)用惰性电极电解葡萄糖[CH2OH(CHOH)4CHO]和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH].电解过程中,葡萄糖酸在阳极生成,对应的电极反应式CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
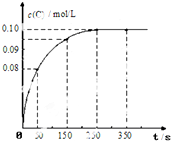 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C) 随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在0~50s的平均速率v(C)=1.6×10-3mol/(L•s) | |
| B. | 该温度下,反应的平衡常数K=0.025 | |
| C. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 | |
| D. | 反应达平衡后,再向容器中充入 1 mol A,该温度下再达到平衡时0.1mol/L<c(C)<0.2mol/L |
 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题: