题目内容
4.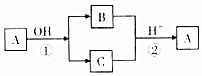 A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )
A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )| A. | A可能是金属,也可能是非金属 | B. | A、B、C含有一种相同的元素 | ||
| C. | B、C的水溶液一定都呈碱性 | D. | 反应①②不一定都是氧化还原反应 |
分析 A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,为歧化反应,则A可能为Cl2或S,应为非金属元素,B、C在酸性条件下发生氧化还原反应又生成单质A,以此解答该题.
解答 解:A.A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,化合价既升高又降低,存在负化合价,应为非金属元素,金属元素不存在负价,故A错误;
B.A发生歧化反应生成B、C,则A、B、C含有一种相同的元素,故B正确;
C.如A为氯气,与碱反应生成氯化物和次氯酸盐,如与氢氧化钠反应,生成的氯化钠的溶液呈中性,故C错误;
D.单质A生成化合物,元素的化合价发生变化,化合物生成A单质,化合价了发生变化,所以反应①和反应②一定属于氧化还原反应,故D错误.
故选B.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,题目难度中等,本题解答的关键是把握反应的特征,从化合价的角度分析该题.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
14.黄酒酿造过程中有部分乙醇最终转化为具有芳香气味的物质,该过程中发生的反应有( )
| A. | 还原反应 | B. | 氧化反应 | C. | 加成反应 | D. | 聚合反应 |
15.按如图所示装置进行下列不同的操作,其中不正确的是( )
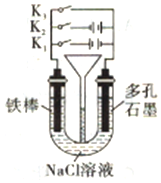

| A. | 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 | |
| B. | 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH- | |
| C. | 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升 | |
| D. | 只闭合K2,U型管左、右两端液面均下降 |
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol-CH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合,生成物中含有NA个分子 | |
| C. | 物质的量相等的Na2O2和Na2O所含有的阴离子数目为NA | |
| D. | H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移2NA个电子 |
19.海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:

注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp=4.68×10-6;Ksp=5.61×10-12.请回答下列问题:
(6)沉淀物X为CaCO3;
(7)滤液N中Ca2+浓度为0.01mol/L;
(8)加NaOH固体调整pH=12.5是否可行否(填“是”“否”);原因是如果pH调制12.5会使氢氧化钙沉淀,会使产品不纯.

| 模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp=4.68×10-6;Ksp=5.61×10-12.请回答下列问题:
(6)沉淀物X为CaCO3;
(7)滤液N中Ca2+浓度为0.01mol/L;
(8)加NaOH固体调整pH=12.5是否可行否(填“是”“否”);原因是如果pH调制12.5会使氢氧化钙沉淀,会使产品不纯.
9.同温同压下,将四个容积相同的干燥圆底烧瓶中分别充满①NH3、②NO2、③混有空气的NH3、④混有空气的NO2进行喷泉实验.最后烧瓶内溶液的物质的量浓度(假设烧瓶内溶液不扩散)大小关系是( )
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ④>①=②=③ |
13.有机物甲、乙的结构如右图所示.下列说法错误的是( )
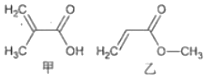

| A. | 甲、乙互为同分异构体 | |
| B. | 甲的一种同分异构体能发生银镜反应 | |
| C. | 甲、乙都能发生取代、加成和水解反应 | |
| D. | 等物质的量的甲和乙与足量的NaOH溶液反应,消耗NaOH的物质的量相等 |
14.检验某无色溶液中是否含有I-,所用试剂不合理的是( )
| A. | 淀粉溶液和氯水 | B. | 硝酸酸化的硝酸银溶液 | ||
| C. | 氯水和四氯化碳 | D. | 溴水和酒精 |