题目内容
18.下列描述中,不符合生产实际的是( )| A. | 电解熔融的氯化钠可制取金属钠,电解熔融的氧化铝可制取金属铝 | |
| B. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| C. | 在镀件上电镀锌,用锌作阳极,镀件作阴极 | |
| D. | 电解法精炼粗铜,用纯铜作阳极,粗铜阴极,CuSO4溶液为电解液 |
分析 A、电解熔融的氯化钠可制取金属钠,电解熔融的氧化铝可制取金属铝;
B、根据阳极材料组成以及电极反应分析判断;
C、电镀时,镀层作阳极,镀件作阴极;
D、电解精炼铜时,纯铜板作阴极,粗作阳极,电解液是含有铜离子的可溶性的盐溶液.
解答 解:A、电解熔融的氯化钠可制取金属钠,电解熔融的氧化铝可制取金属铝,故A正确;
B、电解精炼铜时,因为粗铜含有杂质,所以开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少,故B正确;
C、电镀时,镀层作阳极,镀件作阴极,所以在镀件上电镀锌,用锌作阳极,镀件作阴极,故C正确;
D、电解精炼铜时,纯铜板作阴极,粗作阳极,电解液是含有铜离子的可溶性的盐溶液如硫酸铜等,故D错误.
故选D.
点评 本题综合考查学生原电池和电解池的工作原理以及电解精炼铜的有关知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
6.用如图实验装置进行实验不能达到目的是( )
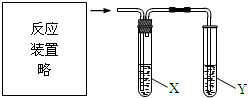
| 选项 | 反应及实验目的 | 试剂X | 试剂Y |
| A | 电石与饱和食盐水混合, 检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
| B | 二氧化锰与浓盐酸混合加热, 验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
| C | 乙醇与浓硫酸加热至170℃, 证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 |
| D | 乙酸溶液与碳酸钠固体混合, 探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |

| A. | A | B. | B | C. | C | D. | D |
6.下列各组元素性质的递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子得电子能力减弱 | |
| D. | Na、K、Rb的电子层数逐渐增多 |
3.下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
| A. | 金属钠与固态水分别受热熔化 | B. | 氯化铵与苯分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 碘与干冰分别受热变为气体 |
10.在一定条件下,可逆反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A. | 单位时间内形成x mol的A-A键,同时形成x mol的A-B键 | |
| B. | 容器内的总压强不随时间变化,气体的密度不再随时间变化 | |
| C. | A2、AB、B2的浓度不再随时间改变 | |
| D. | 单位时间内生成x mol的A2分子,同时生成x mol的B2分子 |
8.下列说法中不正确的是( )
| A. | 锂、钠、钾、铷、铯都具有碱性,故称为碱金属 | |
| B. | 石灰石、纯碱、小苏打、碳酸铵热稳定性最强的是纯碱 | |
| C. | 过氧化钠投入到饱和碳酸钠溶液既能产生白色沉淀,又能产生气体 | |
| D. | 金属Li是密度最小的碱金属,熔点大于Rb |
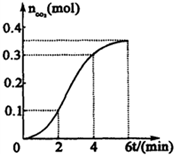 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题: ;
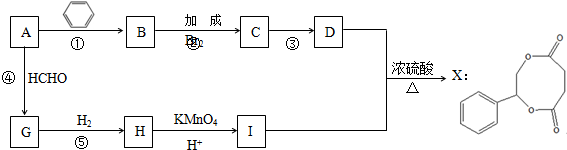
;
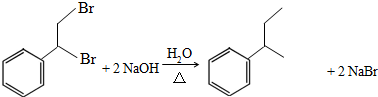 .
.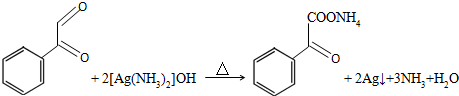 .
.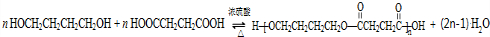 .
. 任意2种.
任意2种.