题目内容
13.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是温度高苯容易挥发、温度低溶解速率小.
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3.
(4)保温除铁过程中加入CuO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀.
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.硝酸的作用是抑制Cu2+的水解;操作X是蒸发浓缩、冷却结晶(填操作名称).
分析 辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液PH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体,
(1)铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原;
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀;
(5)铜离子属于弱碱阳离子,容易水解呈酸性,加入酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,据此解答即可.
解答 解:(1)铁具有还原性,铁离子、铜离子具有氧化性,均可以与金属铁反应被还原,反应的离子反应方程式分别为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+,
故答案为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+;
(2)苯沸点比较低,温度过高苯容易挥发,温度过低溶解速率小,
故答案为:温度高苯容易挥发;温度低溶解速率小;
(3)NOx做还原剂,依据质量守恒和电子守恒写出方程式:4NOx+(5-2x)O2+2H2O=4HNO3,
故答案为:4NOx+(5-2x)O2+2H2O=4HNO3;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,
故答案为:调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀;
(5)铜离子属于弱碱阳离子,容易水解呈酸性,加入硝酸可以抑制其水解,得到晶体的方法是蒸发浓缩溶液,冷却结晶,
故答案为:抑制Cu2+的水解;蒸发浓缩;冷却结晶.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案①取少量该晶体于试管中,加热,发现试管口处有液体,且该液体能使无水硫酸铜变蓝;
②取少量该晶体的溶液于试管中,加入KSCN溶液,没有明显的变化,滴加几滴氯水,溶液显红色;
③取少量该晶体的溶液于试管中,再加入盐酸,没有明显的变化.再加入BaCl2溶液,有白色沉淀产生;
④取少量该晶体的溶液于试管中,加入浓NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时还有白色沉淀产生,该沉淀很快变成灰绿色沉淀最终变为红褐色沉淀.下列说法正确的是( )
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
| A. | 24% | B. | 30% | C. | 40% | D. | 19% |
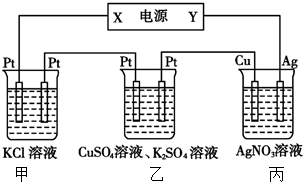
| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |

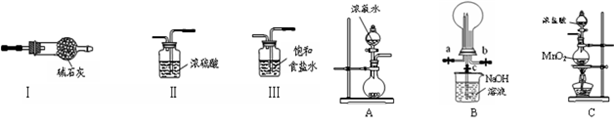
| A. | 实验Ⅰ:导管口气体可被点燃,产生淡蓝色火焰 | |
| B. | 实验Ⅱ:振荡后静置,溶液分层,且两层均接近无色 | |
| C. | 实验Ⅲ:试管中有气泡冒出,溶液颜色无明显变化 | |
| D. | 实验Ⅳ:试管内气体颜色逐渐变浅,试管壁出现油状液滴 |
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 浓硫酸不与铁、铝发生钝化 |
| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
| A. | 胆矾 | B. | 冰、水混合物 | C. | 纯净的盐酸 | D. | 水银 |