题目内容
2.元素X的原子核内只有1个质子.元素Y的阳离子电子层结构和氖原子电子层结构相同,Y、Z和E在周期表里位于同一周期.X和E、Z分别能形成气态氢化物XE和X2Z,它们的水溶液是酸.Z跟Y能形成离子化合物Y2Z.与氖同周期的元素F的气态氢化物FX3,其水溶液能使酚酞试液变红.则X、Y、Z、E、F的元素符号是( )| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
分析 元素X的原子核内只有1个质子.应为H元素,元素Y的阳离子电子层结构和氖原子电子层结构相同,应为Na元素,Y、Z和E在周期表里位于同一周期.X和E、Z分别能形成气态氢化物XE和X2Z,它们的水溶液是酸,则Z为S,E为Cl,Z跟Y能形成离子化合物Y2Z.与氖同周期的元素F的气态氢化物FX3,其水溶液能使酚酞试液变红,为N元素,以此解答该题.
解答 解;元素X的原子核内只有1个质子.应为H元素,元素Y的阳离子电子层结构和氖原子电子层结构相同,应为Na元素,Y、Z和E在周期表里位于同一周期.X和E、Z分别能形成气态氢化物XE和X2Z,它们的水溶液是酸,则Z为S,E为Cl,Z跟Y能形成离子化合物Y2Z,为Na2S,与氖同周期的元素F的气态氢化物FX3,其水溶液能使酚酞试液变红,为氨气,则为N元素,
故选A.
点评 本题考查结构性质位置关系应用,为高考常见题型,侧重于学生的分析能力的考查,推断元素是解题关键,难度中等,注意对基础知识的全面掌握.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
12.用足量CO还原14g 金属氧化物的混合物,将生成的CO2通入足量的澄清石灰水,得到25g沉淀,则该混合物不可能是( )
| A. | FeO和Fe2O3的混合物 | B. | Fe2O3和Fe3O4的混合物 | ||
| C. | CuO和Fe2O3的混合物 | D. | CuO和Fe3O4的混合物 |
13.辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:

已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
(1)写出步骤“还原”中可能发生反应的离子方程式Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2+.
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是温度高苯容易挥发、温度低溶解速率小.
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3.
(4)保温除铁过程中加入CuO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀.
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.硝酸的作用是抑制Cu2+的水解;操作X是蒸发浓缩、冷却结晶(填操作名称).

已知部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)回收S过程中温度控制50℃~60℃之间,不宜过高或过低的原因是温度高苯容易挥发、温度低溶解速率小.
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为4NOx+(5-2x)O2+2H2O=4HNO3.
(4)保温除铁过程中加入CuO的目的是调节溶液的pH,使Fe3+完全转化为Fe(OH)3沉淀.
(5)过滤③所得到的滤液,加入硝酸后,经操作X、过滤④得到硝酸铜晶体.硝酸的作用是抑制Cu2+的水解;操作X是蒸发浓缩、冷却结晶(填操作名称).
7.科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烷基).则下列有关叙述正确的是( )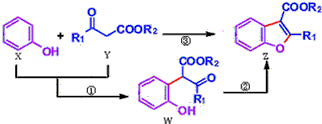

| A. | 反应①属于加成反应 | B. | W中含有三种不同的官能团 | ||
| C. | X、Y、W、Z都能与NaHCO3溶液反应 | D. | 可用溴水或FeCl3溶液鉴别X和W |