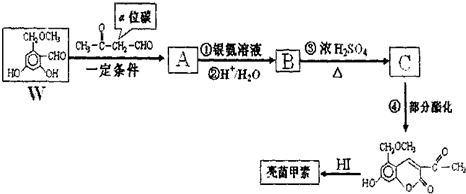
题目内容
Q、R、X、Y、Z(Q、R、X、Y、Z分别代表元素符号)五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn;,
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是 ;在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的 形成配位键.
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,财甲、乙的稳定性大小为 ,甲、乙的沸点大小为 (均用相应的化学式表示).
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答);Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为 .
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 .
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn;,
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,财甲、乙的稳定性大小为
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Z的原子序数为29,则Z为Cu元素;
Q、R、X、Y均为短周期主族元素,Q、R、X、Y、Z五种元素的原子序数依次递增.
Q、X的p轨道为2和4,二者有2个电子层,则为Q为C元素和X为O元素;
Y原子价电子(外围电子)排布msnmpn,s能级容纳电子数为2,则Y可能为C或Si,由于Q为C元素,所以Y为Si元素;
R的核外L层为奇数,所以R有2个电子层,则可能为Li、B、N或F,R的原子序数介于Q与X之间,Q为C元素,X为O元素,则R为N元素.
所以可推出:Q为C,R为N,X为O,Y为Si,Z为Cu.
Q、R、X、Y均为短周期主族元素,Q、R、X、Y、Z五种元素的原子序数依次递增.
Q、X的p轨道为2和4,二者有2个电子层,则为Q为C元素和X为O元素;
Y原子价电子(外围电子)排布msnmpn,s能级容纳电子数为2,则Y可能为C或Si,由于Q为C元素,所以Y为Si元素;
R的核外L层为奇数,所以R有2个电子层,则可能为Li、B、N或F,R的原子序数介于Q与X之间,Q为C元素,X为O元素,则R为N元素.
所以可推出:Q为C,R为N,X为O,Y为Si,Z为Cu.
解答:
解:依据分析可知:Q为C,R为N,X为O,Y为Si,Z为Cu,
(1)Z为Cu元素,Z2+为Cu2+,Cu的价电子排布为3d104s1,失去两个电子,则为3d9,Cu2+的核外电子排布式是:1s22s22p63s23p63d9,Cu2+的空间轨道接受NH3分子提供孤对电子形成配位键,故答案为:1s22s22p63s23p63d9;孤对电子;
(2)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4.因为SiH4 的相对分子质量比CH4大,故分子间作用力大,沸点高,故答案为:CH4>SiH4;CH4<SiH4;
(3)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,即Si<C,而N由于具有半充满状态,故第一电离能比相邻元素大,C<N,所以第一电离能Si<C<N,Q为C元素,C、H形成的相对分子质量为26的物质为C2H2,结构式为H-C≡C-H,单键是σ键,叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2,故答案为:Si<C<N;3:2.
(4)电负性最大的非金属元素是O,最小的非金属元素是Si,两者构成SiO2,属于原子晶体.
故答案为:原子晶体.
(1)Z为Cu元素,Z2+为Cu2+,Cu的价电子排布为3d104s1,失去两个电子,则为3d9,Cu2+的核外电子排布式是:1s22s22p63s23p63d9,Cu2+的空间轨道接受NH3分子提供孤对电子形成配位键,故答案为:1s22s22p63s23p63d9;孤对电子;
(2)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4.因为SiH4 的相对分子质量比CH4大,故分子间作用力大,沸点高,故答案为:CH4>SiH4;CH4<SiH4;
(3)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,即Si<C,而N由于具有半充满状态,故第一电离能比相邻元素大,C<N,所以第一电离能Si<C<N,Q为C元素,C、H形成的相对分子质量为26的物质为C2H2,结构式为H-C≡C-H,单键是σ键,叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2,故答案为:Si<C<N;3:2.
(4)电负性最大的非金属元素是O,最小的非金属元素是Si,两者构成SiO2,属于原子晶体.
故答案为:原子晶体.
点评:以元素推断为载体,考查物质结构与性质、核外电子排布、电离能、化学键、晶体等,是对所学知识的综合运用,难度中等,根据原子结构推断元素是解题关键,注意基础知识的掌握.

练习册系列答案
相关题目
 常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL 0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用 0.1000mol?L-1NaOH溶液滴定 20.00mL 0.1000mol?L-1CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A、点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、点②所示溶液中:c(Na+)=c(CH3COO-) |
| C、点③所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) |
| D、滴定过程中可能出现:c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
向100mL0.1mol/L的NaAlO2溶液中加入一定量的稀HNO3,将所得溶液加热、蒸干并灼烧直至质量不再变化,此时固体的质量为( )
| A、1.09g |
| B、1.20 g |
| C、1.36g |
| D、1.63g |
下列实验操作与安全事故处理错误的是( )
| A、用试管夹从试管底由下往上夹住距离管口约三分之一处,手持试管夹长柄末端,进行加热 |
| B、制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| C、把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
| D、实验时不慎打破温度计水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
下图所示的实验,能达到实验目的是[( )
A、 验证化学能转化为电能 |
B、 验证温度对平衡移动的影响 |
C、 验证铁发生析氢腐蚀 |
D、 验证非金属Cl>C>Si |