题目内容
市场上有一种自热米饭,其饭盒中有一个发热包,在包装盒底准备一包水,水包上安有一根拉绳露于饭盒外,拉动拉绳,水和发热包自动混合,3s-5s内即升温,8min可将250g-300g米饭煮熟.发热过程中温度可达150℃,蒸汽温度达170℃,最长保温时间可达3h.发热过程无任何污染,而且成本低廉,没有任何安全隐患.
某化学兴趣小组对发热包内物质成分提出三种猜想:
A.猜想一:镁粉、铁粉;B.猜想二:镁粉、铁粉、氯化钠;C.猜想三:镁粉、铁粉、氯化钠、碳粉.
该小组同学对发热包内物质进行了如下探究实验.
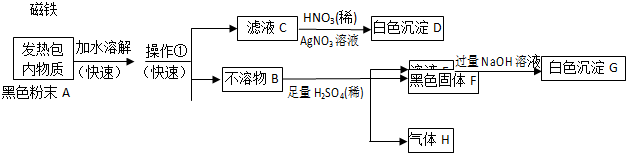
(1)据此判断上述猜想中正确的是 (填A或B或C);操作①的名称是 ;C→D的离子反应方程式为 .
(2)研究发现,发热包“发热”的原理实际上是构成了许多微小的原电池,发生原电池反应,放出热量的缘故.
①在反应初期,原电池中负极为 ;正极电极反应方程式为 .
②在保温阶段,发热包仍然发生着原电池反应,其负极电极反应方程式为 ;保温时间可长达3h的可能原因为 .
某化学兴趣小组对发热包内物质成分提出三种猜想:
A.猜想一:镁粉、铁粉;B.猜想二:镁粉、铁粉、氯化钠;C.猜想三:镁粉、铁粉、氯化钠、碳粉.
该小组同学对发热包内物质进行了如下探究实验.

(1)据此判断上述猜想中正确的是
(2)研究发现,发热包“发热”的原理实际上是构成了许多微小的原电池,发生原电池反应,放出热量的缘故.
①在反应初期,原电池中负极为
②在保温阶段,发热包仍然发生着原电池反应,其负极电极反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用,原电池和电解池的工作原理,物质的检验和鉴别的实验方案设计
专题:
分析:由探究实验可知,黑色粉末加水溶解,滤液C加硝酸和硝酸银生成白色沉淀D为AgCl,则原混合物中一定含NaCl;不溶物B加硫酸生成H为氢气,滤液E与过量NaOH反应生成白色沉淀,则白色沉淀为氢氧化镁,黑色固体F为碳,则猜想三合理,以此来解答.
解答:
解:由探究实验可知,黑色粉末加水溶解,滤液C加硝酸和硝酸银生成白色沉淀D为AgCl,则原混合物中一定含NaCl;不溶物B加硫酸生成H为氢气,滤液E与过量NaOH反应生成白色沉淀,则白色沉淀为氢氧化镁,黑色固体F为碳,
(1)由上述分析可知,C合理,操作①分离不溶性固体与液体,其名称是过滤,C→D的离子反应方程式为Cl-+Ag+=AgCl↓,故答案为:C;过滤;Cl-+Ag+=AgCl↓;
(2)①碳、Mg和水构成原电池,所以能发生电化学腐蚀,该原电池中,活泼金属作负极,碳作正极,负极上Mg失电子发生氧化反应,电极反应式为Mg-2e-=Mg2+;正极上氧气得电子发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:Mg-2e-=Mg2+;O2+4e-+2H2O=4OH-;
②在保温阶段,发热包仍然发生着原电池反应,其负极电极反应方程式为Fe-2e-=Fe2+,保温时间可长达3h的可能原因为氧化还原反应为放热反应,给物质加热使温度升高,故答案为:Fe-2e-=Fe2+;氧化还原反应为放热反应,给物质加热使温度升高.
(1)由上述分析可知,C合理,操作①分离不溶性固体与液体,其名称是过滤,C→D的离子反应方程式为Cl-+Ag+=AgCl↓,故答案为:C;过滤;Cl-+Ag+=AgCl↓;
(2)①碳、Mg和水构成原电池,所以能发生电化学腐蚀,该原电池中,活泼金属作负极,碳作正极,负极上Mg失电子发生氧化反应,电极反应式为Mg-2e-=Mg2+;正极上氧气得电子发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,故答案为:Mg-2e-=Mg2+;O2+4e-+2H2O=4OH-;
②在保温阶段,发热包仍然发生着原电池反应,其负极电极反应方程式为Fe-2e-=Fe2+,保温时间可长达3h的可能原因为氧化还原反应为放热反应,给物质加热使温度升高,故答案为:Fe-2e-=Fe2+;氧化还原反应为放热反应,给物质加热使温度升高.
点评:本题考查分离提纯的综合应用,为高频考点,把握实验流程中发生的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意原电池原理为解答的难点,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
下列说法不正确的是( )
| A、燃着的酒精灯不慎碰翻失火,应该迅速用湿抹布扑盖 |
| B、用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 |
| C、制备摩尔盐的过程中,洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分 |
| D、在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
用一定量的NH4NO3和KH2PO4的固体混合物可以配制无土栽培营养液,已知固体混合物中氮元素的质量分数为28%,则固体混合物中KH2PO4的质量分数为( )
| A、20% | B、25% |
| C、80% | D、85% |
下列说法正确的是( )
| A、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| B、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
| C、在试管中将一定量的浓硝酸,浓硫酸和苯混合,用酒精灯直接加热几分钟,即可制得硝基苯 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A、欲增大平衡状态时c(CH3OH)/c(CO2)的比值,可采用升高温度的方法 |
| B、3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同 |
| C、欲提高H2的平衡转化率只能减小反应容器的体积 |
| D、从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025 mol?L-1?min-1 |