题目内容
向100mL0.1mol/L的NaAlO2溶液中加入一定量的稀HNO3,将所得溶液加热、蒸干并灼烧直至质量不再变化,此时固体的质量为( )
| A、1.09g |
| B、1.20 g |
| C、1.36g |
| D、1.63g |
考点:化学方程式的有关计算
专题:计算题
分析:利用极限法分析,有如下情况:一没有加入硝酸,最终得到固体为NaAlO2,二加入硝酸,恰好生成硝酸钠、氢氧化铝沉淀(或硝酸铝),蒸干灼烧,硝酸钠反应得到亚硝酸钠,氢氧化铝或硝酸铝分解得到氧化铝,最终固体为NaNO2、Al2O3,根据元素守恒计算固体质量进行判断.
解答:
解:NaAlO2的物质的量为0.1L×0.1mol/L=0.01mol,
一若没有进入硝酸,最终得到固体为NaAlO2,生成固体质量为0.01mol×82g/mol=0.82g;
二加入硝酸,恰好生成硝酸钠、氢氧化铝沉淀(或硝酸铝),蒸干灼烧,硝酸钠分解得到亚硝酸钠与氧气,氢氧化铝或硝酸铝分解得到氧化铝,最终固体为NaNO2、Al2O3,根据钠离子守恒,m(NaNO2)=0.01mol×69g/mol=0.69g,根据Al元素守恒,m(Al2O3)=0.01mol×
×102g/mol=0.51g,所得固体质量为0.51g+0.69=1.2,
故0.82g<m(固体)≤1.2g,
故选AB.
一若没有进入硝酸,最终得到固体为NaAlO2,生成固体质量为0.01mol×82g/mol=0.82g;
二加入硝酸,恰好生成硝酸钠、氢氧化铝沉淀(或硝酸铝),蒸干灼烧,硝酸钠分解得到亚硝酸钠与氧气,氢氧化铝或硝酸铝分解得到氧化铝,最终固体为NaNO2、Al2O3,根据钠离子守恒,m(NaNO2)=0.01mol×69g/mol=0.69g,根据Al元素守恒,m(Al2O3)=0.01mol×
| 1 |
| 2 |
故0.82g<m(固体)≤1.2g,
故选AB.
点评:本题考查化学方程式有关计算,关键是利用极限法解答,为易错题目,学生对硝酸盐的分解比较陌生,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列食品加工方法对人体不会造成伤害的是( )
| A、用福尔马林浸泡海鲜防止鱼虾变质 |
| B、用小苏打做发酵粉制面包 |
| C、二氧化硫可广泛用于食品的增白 |
| D、向乳制品中添加三聚氰胺以提高含氮量 |
滴有酚酞试液的下列溶液,经如下操作后溶液颜色变深的是( )
| A、碳酸钠溶液中滴入盐酸 |
| B、水中加入钠 |
| C、氨水中加入少量NH4Cl 固体 |
| D、醋酸溶液微热 |
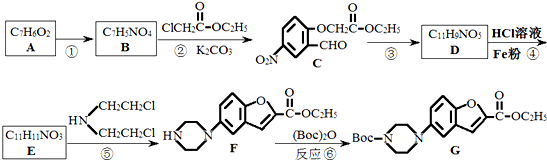
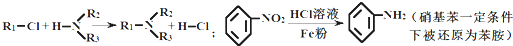
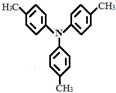 ,请设计合成路线(无机试剂及溶剂任选).
,请设计合成路线(无机试剂及溶剂任选).