题目内容
11.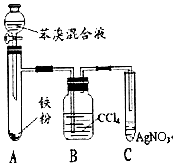 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.试回答:
(1)装置A中制得溴苯的化学方程式是
 .
.(2)装置C中看到的现象是产生浅黄色沉淀.其目的是证明苯和液溴发生的是取代反应.
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是溶液呈橙红色.
如果没有B装置将A、C相连,你认为是否妥当?否(填是或否),理由是溴蒸气溶于水产生溴离子,也可以生成淡黄色沉淀;相应干扰反应的化学方程式为Br2+H2O=HBr+HBrO,HBr+AgNO3=AgBr↓+HNO3.
(4)实验完毕后将A管中的液体倒在盛有冷水的烧杯中,烧杯下(填“上”或“下”)层为溴苯.此溴苯中因溶有Br2而呈现红褐色.要得到纯净的产物,需先用分液漏斗(填仪器名称)分离出粗产品,再在粗产品中加入NaOH充分洗涤,分液后,在粗产品中加入无水氯化钙干燥,过滤,最后蒸馏(填操作),即可得到纯净的溴苯.
分析 (1)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫;
(2)根据苯和溴发生取代反应生成溴化氢,设计实验证明反应后的溶液中含有溴离子即可;
(3)根据苯与溴发生的取代反应生成溴化氢,但由于溴具有挥发性,所以制得的溴化氢中含有溴蒸气,利用溴单质易溶于有机溶剂,所以应选用CCl4除去HBr中的Br2,如果没有B装置将A、C直接相连,由于溴蒸气溶于水产生溴离子,也可以生成淡黄色沉淀,据此解答;
(4)根据溴苯的物理性质以及溴单质和溴苯性质的差异来回答,溴苯不溶于水,密度大于水,用分液漏斗分液,反应后得到的溴苯中溶有少量溴、苯杂质,依据它和溴苯的性质不同除杂,互溶的有机物常采用蒸馏的方法分离.
解答 解:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,化学方程式是 ,
,
故答案为: ;
;
(2)苯和溴发生取代反应生成溴化氢,故利用硝酸银检验出反应后有溴离子则可证明,溴离子和银离子反应生成溴化银浅黄色沉淀,所以现象装置C中产生浅黄色沉淀,则苯和液溴发生的是取代反应,
故答案为:产生浅黄色沉淀;苯和液溴发生的是取代反应;
(3)由于溴具有挥发性,制得的溴化氢中含有溴蒸气,利用溴单质易溶于有机溶剂,四氯化碳溶解溴单质,四氯化碳溶液呈现橙红色,用CCl4除去HBr中的Br2,如果没有B装置将A、C直接相连,由于溴蒸气溶于水产生溴离子,化学反应方程式为Br2+H2O=HBr+HBrO,HBr+AgNO3=AgBr↓+HNO3,也可以生成淡黄色沉淀,
故答案为:溶液呈橙红色;否;溴蒸气溶于水产生溴离子,也可以生成淡黄色沉淀;Br2+H2O=HBr+HBrO,HBr+AgNO3=AgBr↓+HNO3;
(4)溴和苯在催化剂不加热的条件下反应生成溴苯是一种密度比水大,并且不溶于水的褐色物质,所以在烧杯下层,用分液漏斗分液,在粗产品溴苯中还含有溴单质,而呈现红褐色,溴苯提纯的方法是:先水洗,把可溶物溶解在水中,然后过滤除去未反应的铁屑,再加NaOH溶液,反应的实质是:Br2+2OH-=Br-+BrO-+H2O,把未反应的Br2变成NaBr和NaBrO洗到水中,然后加干燥剂,无水氯化钙能干燥溴苯,反应后得到的溴苯中溶有少量未反应的苯,苯和溴苯互溶,但苯的沸点低,所以采用蒸馏的方法进行分离,溴苯留在母液中,
故答案为:下;Br2;分液漏斗;NaOH;蒸馏.
点评 本题考查了制取溴苯并探究其反应类型实验,侧重考查实验、分析能力,熟悉苯的结构和性质是解题的关键,注意苯和液溴发生取代反应,题目难度中等.

| A. | 硅酸钠溶液 | B. | 氯化钙溶液 | C. | 氢氧化钙溶液 | D. | 碳酸钠饱和溶液 |
| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 ,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
,它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.②甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂MnO2(填化学式),有气体产生.
(2)有一瓶澄清的溶液,可有含有大量的NO3-、Fe3+、NH4+、H+、K+、Mg2+、Al3+、SO42-、Ba2+、CO32-、Cl-、I-,现进行如下实验:
①测知溶液显酸性;
②取样加少量四氯化碳和数滴新制氯水,四氯化碳层溶液呈紫红色;
③另取样滴加稀NaOH溶液,使深液变为碱性,此过程中无沉淀生成;
④取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
由此可以推断:
溶液中肯定存在的离子有H+、NH4+、Ba2+、I-.溶液中不能确定是否存在的离子有K+、Cl-.
| A. | 体系的压强不再发生变化 | |
| B. | 混合气体的平均相对分子质量不再发生变化 | |
| C. | v正(CO)=v逆(H2O) | |
| D. | 1 mol H-H键断裂的同时断裂2 mol H-O键 |
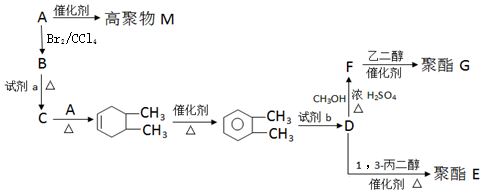
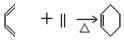
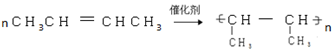 ②B→C
②B→C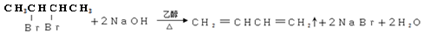
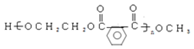 .
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)