题目内容
3.呼吸面具中常用Na2O2来做供氧剂,发生反应2Na2O2+2CO2═2Na2CO3+O2↑,在反应中Na2O2是:既是氧化剂也是还原剂CO2是:既不是氧化剂也不是还原剂(填氧化剂,还原剂,既不是氧化剂也不是还原剂),若有1mol的O2生成,转移了2mol的电子;Na2O2中阴阳离子个数比1:2;0.5mol CO2中,有11mol电子,0.5mol碳原子,在标准状况下所占有的体积11.2L,含有的O原子个数NA,摩尔质量44g/mol.分析 由方程式可知反应中只有O元素的化合价发生变化,反应中Na2O2既是氧化剂又是还原剂,根据化合价的变化判断电子转移的数目,由此分析解答.
解答 解:发生反应2Na2O2+2CO2═2Na2CO3+O2↑,在反应中Na2O2是既是氧化剂也是还原剂,二氧化碳中各元素的化合价不变,所以二氧化碳既不是氧化剂也不是还原剂,若有1mol的O2生成,转移了2mol的电子;Na2O2中阴离子为过氧根离子,所以阴阳离子个数比2:1;0.5mol CO2中,有0.5×(6+8×2)=11mol电子,0.5mol碳原子,在标准状况下所占有的体积0.5×22.4L/mol=11.2L,含有的O原子个数0.5×2×NA=NA,摩尔质量44g/mol,
故答案为:既是氧化剂也是还原剂; 既不是氧化剂也不是还原剂; 2; 1:2;11; 0.5;11.2L; NA;44g/mol.
点评 本题考查氧化还原反应,题目难度不大,解答该类题目的关键是能把握元素的化合价的变化,注意有关物理量转化过程中公式的使用.

练习册系列答案
相关题目
2.不属于定量仪器的是( )
| A. | 滴定管 | B. | 量筒 | C. | 电子天平 | D. | 烧杯 |
18.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数)是( )
| A. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | ||
| C. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | D. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ |
8.一定条件下,24mL的CO2和N2的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体20mL,则原混合气体中CO2的体积分数为( )
| A. | 33.3% | B. | 44% | C. | 56% | D. | 66.7% |
12.把一支充满NO2气体的试管,倒立于盛水的水槽中,充分反应后,下列说法正确的是( )
| A. | 试管中剩余气体约占试管体积的$\frac{1}{2}$ | B. | 试管中剩余气体约占试管体积的$\frac{2}{3}$ | ||
| C. | 剩余气体呈红棕色 | D. | 剩余气体呈无色 |
13.下列有关说法正确的是( )
| A. | 工业上通常用电解钠、铁、铜对应的氯化物来制备这三种金属的单质 | |
| B. | 陶瓷、玻璃、水泥属于传统无机硅酸盐材料 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了“丹砂”,该过程无氧化还原反应发生 | |
| D. | “青篙一握,以水二升渍,绞取汁”屠呦呦对青蒿素的提取属于化学变化 |
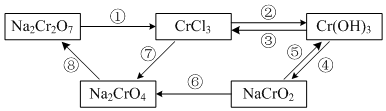
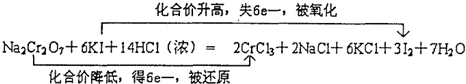
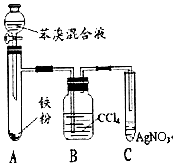 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.