题目内容
10.下列反应中硫酸既表现氧化性,又表现出酸性的是( )| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
分析 硫酸既能表现出酸性又表现出氧化性,在反应中应生成硫酸盐,且硫酸被还原生成二氧化硫等物质,据此解答.
解答 解:A.实验室用浓硫酸干燥氯气、氯化氢等气体,只表现硫酸的吸水性,故A不选;
B.将KI与浓硫酸混合,有紫色蒸气产生,碘离子被氧化,生成碘单质,体现浓硫酸的强氧化性,同时生成水和硫酸钾,体现其酸性,故B选;
C.浓硫酸与氧化铁反应,生成硫酸铁和水,只表现硫酸的酸性,故C不选;
D.木炭粉与浓硫酸反应生成二氧化碳和二氧化硫、水,只表示硫酸的强氧化性,故D不选;
故选:B.
点评 本题考查了元素化合物知识,熟悉硫酸的强氧化性、酸性是解题关键,题目难度不大.

练习册系列答案
相关题目
20.(1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
(2)下表是几种常见弱酸的电离平衡常数(25℃)
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是CH3COOH>H2CO3>HClO;25℃时,等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是NaAc<NaClO<Na2CO3.
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
(2)下表是几种常见弱酸的电离平衡常数(25℃)
| 酸 | H2CO3 | CH3COOH | HClO |
| K | K1=4.4×10-7;K 2=4.7×10-11 | K=1.76×10-5 | K=2.95×10-8 |
(3)常温下,将0.02mol•L-1 的 Ba(OH)2溶液100mL和0.02mol•L-1的NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为12.
(4)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11. 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,MgF2(填化学式)溶液中的 c(Mg2+)大.
18.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 升高温度变化反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| C. | 一个反应的平衡常数越大,则该反应速率也越大 | |
| D. | 化学反应的实质是化学键的断裂和形成,化学反应前后化学键总数不变 |
5.使用单质铜制取硝酸铜,最适宜的方法是( )
| A. | Cu+稀HNO3 | B. | Cu$\stackrel{空气、△}{→}$CuO$\stackrel{硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu+浓HNO3 | D. | Cu$\stackrel{Cl_{2}}{→}$CuCl2 $\stackrel{AgNO_{3}}{→}$ Cu(NO3)2 |
2.不属于定量仪器的是( )
| A. | 滴定管 | B. | 量筒 | C. | 电子天平 | D. | 烧杯 |
12.把一支充满NO2气体的试管,倒立于盛水的水槽中,充分反应后,下列说法正确的是( )
| A. | 试管中剩余气体约占试管体积的$\frac{1}{2}$ | B. | 试管中剩余气体约占试管体积的$\frac{2}{3}$ | ||
| C. | 剩余气体呈红棕色 | D. | 剩余气体呈无色 |
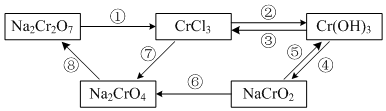
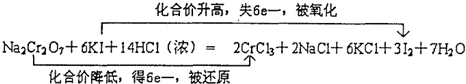
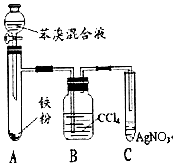 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.