题目内容
20.在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )| A. | 体系的压强不再发生变化 | |
| B. | 混合气体的平均相对分子质量不再发生变化 | |
| C. | v正(CO)=v逆(H2O) | |
| D. | 1 mol H-H键断裂的同时断裂2 mol H-O键 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A.反应前后气体的物质的量发生变化,容积可变,则容器中始终压强不变,不能说明反应到达平衡,故A选;
B.该反应容器体积不变、但混合气体质量改变,所以混合气体的摩尔质量改变,当体系的气体的密度和平均相对分子质量不再发生变化时该反应达到平衡状态,故B不选;
C.V正(CO)=V逆(H2O)=V逆(CO),CO的正逆反应速率相等,该反应达到平衡状态,故C不选;
D.1 mol H-H键断裂等效于生成2 mol H-O键的同时断裂2 mol H-O键,说明反应达平衡状态,故D不选.
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 升高温度变化反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| C. | 一个反应的平衡常数越大,则该反应速率也越大 | |
| D. | 化学反应的实质是化学键的断裂和形成,化学反应前后化学键总数不变 |
8.一定条件下,24mL的CO2和N2的混合气体通过足量的过氧化钠粉末,充分反应后得到相同状况下的气体20mL,则原混合气体中CO2的体积分数为( )
| A. | 33.3% | B. | 44% | C. | 56% | D. | 66.7% |
5.利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
| A. | BaCl2、HCl、品红溶液 | B. | BaCl2、H2SO4、石蕊溶液 | ||
| C. | AgNO3和HNO3溶液 | D. | AgNO3和BaCl2溶液 |
12.把一支充满NO2气体的试管,倒立于盛水的水槽中,充分反应后,下列说法正确的是( )
| A. | 试管中剩余气体约占试管体积的$\frac{1}{2}$ | B. | 试管中剩余气体约占试管体积的$\frac{2}{3}$ | ||
| C. | 剩余气体呈红棕色 | D. | 剩余气体呈无色 |
9.在标准状况下,把22.4LNO,NO2的混合气体通入装有1L水的密闭容器中,再向该容器中充入足量的O2,完全反应后(假设反应过程中液体体积不变),容器中所得的溶液的物质的量浓度为( )
| A. | 无法计算 | B. | 1mol•L-1 | C. | 0.5mol•L-1 | D. | 1.5mol•L-1 |
10.下列仪器为冷凝管的是( )
| A. |  | B. |  | C. |  | D. |  |
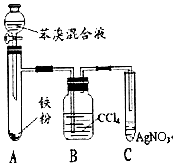 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.