题目内容
13.SO2常用于漂白各种竹林制品.如下实验现象能体现SO2漂白性的是( )| A. | SO2使酸性高锰酸钾溶液褪色 | |
| B. | SO2使滴有酚酞的氢氧化钠溶液褪色 | |
| C. | SO2使品红溶液褪色 | |
| D. | SO2使溴水褪色 |
分析 SO2具有漂白性,能使品红溶液褪色,以此来解答.
解答 解:A.SO2使酸性KMnO4溶液褪色,发生氧化还原反应,与其还原性有关,故A不选;
B.SO2使含酚酞的NaOH溶液褪色,发生二氧化硫与NaOH的复分解反应,与其酸性氧化物性质有关,故B不选;
C.SO2使品红溶液褪色,与其漂白性有关,故C选;
D.SO2使溴水褪色,发生氧化还原反应,与其还原性有关,故D不选;
故选C.
点评 本题考查二氧化硫的性质,为高频考点,把握二氧化硫的还原性、漂白性及酸性氧化物的性质为解答的关键,注意褪色时发生的反应,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
3.下列分子属于手性分子的是( )
| A. | CCl2F2 | B. | 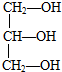 | C. | CH3CH2OH | D. | 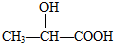 |
4. 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上). (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.
实际生产过程中,①中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去;②中调节pH为3.5时,沉淀的主要成分是Fe(OH)3.
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上).
 (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.| 化学式 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
1.下列说法中不正确的是( )
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 可以通过灼烧时的特殊气味来鉴别蛋白质 | |
| C. | 用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| D. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 |
8.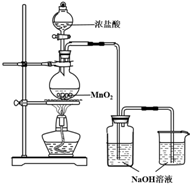 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.
(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
(4)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作A中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性.
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
为探究操作A中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
18.化学反应经常伴随着颜色变化,下列有关反应获得的颜色不正确的是( )
| A. | 蛋白质遇浓硝酸呈现黄色 | |
| B. | 淀粉溶液遇单质碘呈现蓝色 | |
| C. | 苯酚显弱酸性,其溶液可以使石蕊试液变红色 | |
| D. | 苯酚在空气中氧化呈现粉红色 |
5.下列关于有机物因果关系的叙述中,完全正确的一组是( )
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯和乙烯都能与溴水发生加成反应 |
| B | 乙酸分子中含有羧基 | 可与NaHCO3溶液反应生成CO2 |
| C | 纤维素和淀粉的化学式均为(C6H10O5)n | 它们属于同分异构体 |
| D | 乙酸乙酯和乙烯一定条件下都能与水反应 | 两者属于同一反应类型 |
| A. | A | B. | B | C. | C | D. | D |

 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题:
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料经发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.结合有关知识,回答下列问题: