题目内容
4.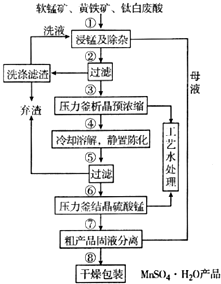 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗.
(2)“浸锰”反应中往往有副产物MnS2O6的生成.温度对“浸锰”反应的影响如图1、图2所示,为减少MnS2O6的生成,“浸锰”的适宜温度为150℃(或150℃以上).
 (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.| 化学式 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(4)⑤中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4.用平衡移动原理解释加入MnS的作用:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)检验⑥中沉淀是否洗涤干净的方法是取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
分析 (1)依据过滤装置和操作步骤选择玻璃仪器;
(2)根据“浸锰”温度与MnS2O6 的生成率的关系图进行解答,当温度150℃以上时,MnS2O6 的生成率几乎为0;
(3)根据表中氢氧化物的pH进行分析解答,调pH为3.5时只有Fe(OH)3开始沉淀,所以沉淀的主要成分是Fe(OH)3;二氧化锰有氧化性,能氧化二价铁离子和二氧化硫,所以①中加入一定量纯MnO2粉末,能将Fe2+氧化为Fe3+,将过量的SO2氧化除去;
(4)根据平衡移动的原理,当生成物的浓度减少时,平衡向正反应方向移动,CuS比MnS更难溶,MnS不断溶解生成更难溶的CuS;
(5)沉淀会附着SO42-离子,取最后一次洗涤液,用酸化的BaCl2溶液检验是否含有SO42-.
解答 解:(1)实验室在过滤操作过程中,使用的玻璃仪器名称为烧杯、玻璃棒、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)根据“浸锰”温度与MnS2O6 的生成率的关系图,当温度150℃以上时,MnS2O6 的生成率几乎为0,所以为减少MnS2O6 的生成,“浸锰”的适宜温度是150℃(或150℃以上),
故答案为:150℃(或150℃以上);
(3)查阅表调pH为3.5时只有Fe(OH)3开始沉淀,所以沉淀的主要成分是Fe(OH)3;二氧化锰有氧化性,能氧化二价铁离子和二氧化硫,所以①中加入一定量纯MnO2粉末,能将Fe2+氧化为Fe3+,将过量的SO2氧化除去,反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,MnO2+SO2=Mn2++SO42-,
故答案为:将Fe2+氧化为Fe3+,将过量的SO2氧化除去;Fe(OH)3;
(4)③中所得的滤液中含有Cu2+,添加过量的难溶电解质MnS,CuS比MnS更难溶,所以MnS不断溶解,
MnS(S)?Mn2+(aq)+S2-(aq);S2-(aq)+Cu2+(aq)?CuS(S)平衡右移,使Cu2+除去,
故答案为:MnS存在沉淀溶解平衡,MnS(S)?Mn2+(aq)+S2-(aq),加入后铜离子和硫离子结合市场难溶的硫化铜沉淀,S2-(aq)+Cu2+(aq)?CuS(S) 生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去;
(5)沉淀会附着SO42-离子,取最后一次洗涤液,滴加酸化的BaCl2溶液,无沉淀生成,说明已洗净,反之硫酸根离子和钡离子结合生成硫酸钡沉淀,表明未洗干净,有SO42-;
故答案为:取少量最后一次洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净;反之则未洗干净.
点评 本题主要考查了制备高纯碳酸锰实验方案,读懂工艺流程图,掌握平衡移动原理、理解离子反应的本质是解答的关键,本题实验综合性强,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/mol•L-1 | 6 | 3 | 2 | 2 |
| c(B)/mol•L-1 | 5 | 3.5 | 3 | 3 |
| c(C)/mol•L-1 | 1 | 2.5 | 3 | 3 |
| A. | 在容器中发生的反应为2A+B?2C | |
| B. | 该温度下,此反应的平衡常数为0.25 | |
| C. | A的平衡转化率比B的平衡转化率低 | |
| D. | 起始加入的A、B物质的量相等 |
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | KOH(aq)+HNO3(aq)═KNO3+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1(反应热) |
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电作用力形成的化学键,叫离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中不一定含有金属元素 |
| A. | 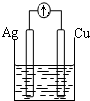 稀硫酸 | B. | 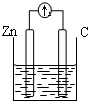 AgNO3(aq) | C. | 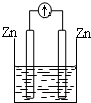 蔗糖 | D. | 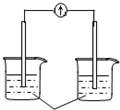 稀硫酸 |
| A. | SO2使酸性高锰酸钾溶液褪色 | |
| B. | SO2使滴有酚酞的氢氧化钠溶液褪色 | |
| C. | SO2使品红溶液褪色 | |
| D. | SO2使溴水褪色 |
| A. | 反应时负极附近pH增大 | B. | 电池总反应为2H2+O2=2H2O | ||
| C. | O2在正极发生还原反应 | D. | 工作时OH-向负极移动 |

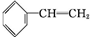 +Br2→
+Br2→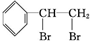 ,反应类型是加成反应.
,反应类型是加成反应.