题目内容
8.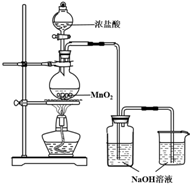 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.(1)写出装有浓盐酸的仪器名称分液漏斗,A中烧瓶内进行的反应中浓盐酸体现出的化学性质是酸性和还原性
(2)写出装置B中发生的所有反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O
(3)装置c的作用是吸收多余氯气,避免污染空气
反应停止后,各取洗气瓶中无色溶液5mL分别进行了如下实验:
| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
为探究操作A中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(5)操作B中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
分析 制备家用消毒液,并探究其性质:装置A:盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,装置B:氯气和氢氧化钠反应:
Cl2+2NaOH═NaClO+NaCl+H2O,制得消毒液,副反应氯化氢和氢氧化钠反应,装置C:氯气有毒,尾气需用装置C中氢氧化钠溶液吸收.
(1)根据仪器的构造以及常见仪器的名称分析,该仪器名称是分液漏斗;盐酸在该反应中和氧化物反应表现酸性,化合价升高体现还原性;
(2)氯化氢易挥发,装置B中,除了氯气和碱反应外,还有氯化氢和碱的中和反应;
(3)利用氯气和氢氧化钠溶液反应来处理尾气;
(4)同体积、同PH=13的溶液中,30min后褪色,而消毒液,5min后褪色,通过对比实验,得出此实验小组制备的消毒液具有漂白性;
(5)操作b中溶液变成黄绿色为氯气,是因为氯离子、次氯酸根离子在酸性条件下发生氧化还原反应,生成氯气.
解答 解:(1)仪器A具有球形特征的漏斗且带有玻璃活塞,该仪器名称是分液漏斗;装置A:盐酸和二氧化锰在加热条件下反应4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O,氯化氢中氯元素的化合价由-1价→0价,作还原剂,氯化氢和二氧化锰反应生成氯化锰和水,体现酸性,所以盐酸的作用为酸性和还原性,
故答案为:分液漏斗;酸性和还原性;
(2)氯化氢易挥发,在加热的条件下,部分氯化氢进入装置B与氢氧化钠发生中和反应,反应方程式为:HCl+NaOH=NaCl+H2O,主要反应为氯气和氢氧化钠反应:Cl2+2NaOH═NaClO+NaCl+H2O,制得消毒液,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaOH=NaCl+H2O;
(3)氯气有毒,为了防止多余的氯气污染空气,用NaOH溶液吸收,该反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:吸收多余氯气,避免污染空气;
(4)酚酞在强碱性溶液中红色会褪去,但同样体积、同PH值的氢氧化钠溶液,滴加2滴酚酞溶液变红,30min后褪色,而消毒液,pH=13,溶液变红,5min后褪色,褪色时间短,说明此实验小组制备的消毒液具有漂白性,
故答案为:5mL,pH=13;
(5)次氯酸根中氯为+1价,氯离子为-1价,在酸性条件下发生归中反应,生成氯气,反应为:2H++ClO-+Cl-═Cl2↑+H2O,黄绿色气体为氯气,
故答案为:2H++ClO-+Cl-═Cl2↑+H2O.
点评 本题以消毒液考查物质的成分的实验探究,明确物质的性质及发生的化学反应为解答的关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ/mol
②4NH3(g)+3O2(g)?2N2(g)+6H2O(g)△H=-1268kJ/mol
下列说法中不正确的是( )
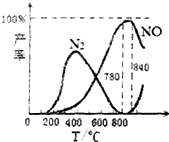
| A. | N2(g)+O2(g)?2NO(g)△H=+181.5kJ/mol | |
| B. | NH3的燃烧热为226.25kJ/mol | |
| C. | 工业上氨催化氧化生成NO时,温度应控制在780~840℃之间 | |
| D. | 用铂丝做催化剂,利用反应①来制备硝酸 |
| A. |  稀硫酸 | B. |  AgNO3(aq) | C. | 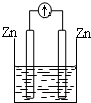 蔗糖 | D. | 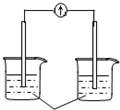 稀硫酸 |

| A. | 拆开2molH2(g)和1 molO2 (g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 molH2O(g),共吸收1852 kJ能量 | |
| C. | 2 molH2(g)和1 molO2(g)反应生成2 molH2O(1),共吸收484 kJ能量 | |
| D. | 2 molH2(g)和1 molO2 (g)反应生成2 moIH2O(g),共放出484 kJ能量 |
| A. | SO2使酸性高锰酸钾溶液褪色 | |
| B. | SO2使滴有酚酞的氢氧化钠溶液褪色 | |
| C. | SO2使品红溶液褪色 | |
| D. | SO2使溴水褪色 |
| A. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,可以减少对环境的污染 | |
| C. | 乙醇和汽油都是纯净物,而乙醇汽油是混合物 | |
| D. | 乙醇和汽油都属于烃的衍生物 |
| A. | 6A% | B. | 10A% | C. | $\frac{A}{6}$% | D. | (100-$\frac{7A}{6}$)% |
| A. | 甲烷与丁烷 | B. | 丁烷与异丁烷 | C. | 氧气与臭氧 | D. | 12C和13C |
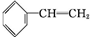 +Br2→
+Br2→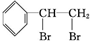 ,反应类型是加成反应.
,反应类型是加成反应.