题目内容
下列叙述错误的是( )
| A、标准状况下,5LCH4与5LNH3的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5NA |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的质量 |
| D、同温、同压下,CO和CO2的密度比为7:11 |
考点:物质的量的相关计算
专题:
分析:A.相同条件下,气体体积之比等于其分子数目之比,结合分子含有原子数目判断;
B.常温常压下,气体摩尔体积大于22.4L/mol;
C.相同条件下,气体体积之比等于其分子数目之比,结合m=nM判断质量;
D.同温同压下,气体密度之比等于其相对分子质量之比.
B.常温常压下,气体摩尔体积大于22.4L/mol;
C.相同条件下,气体体积之比等于其分子数目之比,结合m=nM判断质量;
D.同温同压下,气体密度之比等于其相对分子质量之比.
解答:
解:A.相同条件下,气体体积之比等于其分子数目之比,5LCH4与5LNH3的分子个数之比为1:1,含有原子数目之比为5:4,故A正确;
B.常温常压下,气体摩尔体积大于22.4L/mol,11.2L O3的物质的量小于0.5mol,所含氧原子个数小于1.5NA,故B错误;
C.相同条件下,气体体积之比等于其分子数目之比,相同体积的N2和CO气体具有相同的分子数,二者摩尔质量均为28g/mol,故二者质量相同,故C正确;
D.同温同压下,气体密度之比等于其相对分子质量之比,CO和CO2的密度比为28:44=7:11,故D正确,
故选B.
B.常温常压下,气体摩尔体积大于22.4L/mol,11.2L O3的物质的量小于0.5mol,所含氧原子个数小于1.5NA,故B错误;
C.相同条件下,气体体积之比等于其分子数目之比,相同体积的N2和CO气体具有相同的分子数,二者摩尔质量均为28g/mol,故二者质量相同,故C正确;
D.同温同压下,气体密度之比等于其相对分子质量之比,CO和CO2的密度比为28:44=7:11,故D正确,
故选B.
点评:本题考查阿伏伽德罗定律及其推论,难度不大,注意根据PV=nRT理解.

练习册系列答案
相关题目
下列分子中所有原子不可能共同处在同一平面上的是( )
A、 |
| B、HC≡C-C≡CH |
| C、CH2=CHCl |
| D、H2CO3 |
下列叙述正确的是( )
| A、在醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的PH<7 |
| C、1.0×10-3盐酸的PH=3,1.0×10-8盐酸的PH=8 |
| D、若1mLPH=1的盐酸与100mLNaOH溶液混合后,溶液的PH=7则NaOH溶液的PH=11 |
下列说法正确的是( )
A、根据反应Cu+H2SO4
| ||||
| B、电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是Cu2+、H+、Pb2+ | ||||
| C、含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体 | ||||
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
下列说法正确的是( )
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C、1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
将1mol SO2和1mol O2通入体积不变的密闭容器中,在一定条件下发生反应2SO2(g)+O2(g)
2SO3(g),达到平衡时SO3 为0.3mol,此时若移走0.5mol O2和0.5mol SO2,相同温度下再次达到新平衡时SO3的物质的量为( )
| 催化剂 |
| △ |
| A、0.3mol |
| B、0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
下列物质的电子式书写正确的是 ( )
A、 |
B、 |
C、 |
D、 |
根据如图示判断下列叙述符合事实的是( )
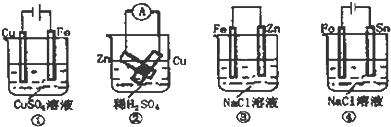

| A、按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B、按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C、按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D、按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |