题目内容
8.实验室用MnO2和浓HCl加热制取Cl2时,有14.6gHCl被氧化,将所得气体全部用石灰水吸收,可得漂白粉质量是( )| A. | 14.3g | B. | 25.4g | C. | 28.6g | D. | 50.6g |
分析 发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,可得关系式:4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2,据此计算.
解答 解:由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
可得以下关系:4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2,
设生成漂白粉的质量为m,则:
4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2
4×36.5g 254g
14.6g m(漂白粉)
所以m(漂白粉)=$\frac{14.6×254}{4×36.5}$=25.4g,
故选:B.
点评 本题考查氯气的实验室制法及氯气和消石灰反应的有关计算,注意对方程式质量关系的理解与关系式的应用,难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
5.在下水管道里,因某些有机物的腐败,常会产生一种有臭鸡蛋气味的有害气体,该气体是( )
| A. | CO | B. | CH4 | C. | SO3 | D. | H2S |
6.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 燃放烟花产生的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 废旧电池应集中回收,并填埋处理 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 |
3.Na2CO3俗称纯碱,是基本化工原料.下列涉及Na2CO3的方程式中,正确的是( )
| A. | Na2O2与CO2反应生成Na2CO3:Na2O2+CO2═Na2CO3+O2 | |
| B. | Na2CO3溶液呈碱性:CO32-+H2O?H2CO3+OH- | |
| C. | Na2CO3溶液除去CH3COOC2H5中的CH3COOH:CO32-+2H+═CO2↑+H2O | |
| D. | 饱和Na2CO3溶液处理水垢中的CaSO4:CO32-+CaSO4═CaCO3+SO42- |
20.合成药物异搏定路线中某一步骤如图:
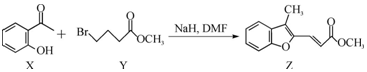
下列说法错误的是( )

下列说法错误的是( )
| A. | 物质X中所有碳原子可能在同一平面内 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
17.用NaOH固体配制0.1mol/L的NaOH溶液,下列操作或说法正确的是( )
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
18.某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究.
【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2.
检查该装置气密性的方法是从量气管右侧管口加水至左右两管出现液面高度差时停止加水,若较长时间能保持液面高度差不变,则说明装置气密性好.
比较实验I和Ⅱ可以得出的结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
【实验二】探究铁的电化学腐蚀.

①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面下降右侧液面上升(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:吸氧腐蚀消耗氧气,反应放热使气体温度升高,容器内压强恰好不变,液面没有升降.实际观察到的现象可能与预测并不一致,装置气密性良好,原因是发生吸氧腐蚀消耗氧气,气体分子数减小.
【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |
比较实验I和Ⅱ可以得出的结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
【实验二】探究铁的电化学腐蚀.

①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面下降右侧液面上升(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:吸氧腐蚀消耗氧气,反应放热使气体温度升高,容器内压强恰好不变,液面没有升降.实际观察到的现象可能与预测并不一致,装置气密性良好,原因是发生吸氧腐蚀消耗氧气,气体分子数减小.