题目内容
20.合成药物异搏定路线中某一步骤如图: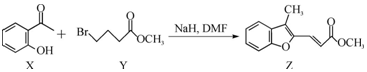
下列说法错误的是( )
| A. | 物质X中所有碳原子可能在同一平面内 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
分析 A.X中苯环、羰基均为平面结构,且直接相连;
B.X含酚-OH,可发生显色反应;
C.X中苯环与羰基均与氢气发生加成反应,而Y不能与氢气发生加成反应;
C.X中酚-OH与NaOH反应,Y中-Br、-COOC-均与NaOH反应.
解答 解:A.X中苯环、羰基均为平面结构,且直接相连,则物质X中所有碳原子可能在同一平面内,故A正确;
B.X含酚-OH,可发生显色反应,Z中不含,则可用FeCl3溶液鉴别Z中是否含有X,故B正确;
C.Y含-COOC-,不能与氢气发生加成反应,故C错误;
C.X中酚-OH与NaOH反应,Y中-Br、-COOC-均与NaOH反应,则等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意酯基不能发生加成反应,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
17.关于下列物质的用途的说法错误的是( )
| A. | 乙二醇可用于配制汽车防冻液 | |
| B. | 部分卤代烃可用作灭火剂 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 甲醛的水溶液(福尔马林)可用于防腐 |
18.X、Y、Z为短周期元素,原子序数依次增大.X原子最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族.下列叙述不正确的是( )
| A. | 原子半径:Y>Z | |
| B. | X元素的一种单质可用于消毒杀菌 | |
| C. | Y的单质在空气中放置表面易生成一层致密的氧化膜 | |
| D. | Z的单质在氧气中点燃可生成两种酸性氧化物 |
8.实验室用MnO2和浓HCl加热制取Cl2时,有14.6gHCl被氧化,将所得气体全部用石灰水吸收,可得漂白粉质量是( )
| A. | 14.3g | B. | 25.4g | C. | 28.6g | D. | 50.6g |
15.氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
①反应在0~2min内的平均反应速率v(H2)=0.02mol/L.min
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
CaO(s)+CO2(g)?CaCO3(s)△H=-172kJ•mol-1
CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-187kJ•mol-1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-228kJ•mol-1.
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)?CH4(g)+2H2O(g)和CaO(s)+CO2(g)?CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
| 物质 N(mol) 时间(min) | CO2 | H2 | CaO |
| 0 | 0.50 | 1.00 | 0.40 |
| 2 | 0.35 | 0.60 | a |
| 6 | 0.20 | 0.20 | b |
| 8 | 0.20 | 0.20 | b |
②b=0.10
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是AC(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2,CaCO3质量减小 D.充入少量CO2,c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的化学平衡常数K=$\frac{2}{3}$.若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为0<x$<\root{4}{0.015}$
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2mol•L-1 NaOH溶液中,下列说法正确的是CD
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32-)>c(OH- )>c(HCO3-)>c(H+)
D.c(OH-)=2c(H2CO3)+c(HCO3- )+c(H+ )
12.下列叙述中正确的是( )
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
9.不具有10个电子的微粒是( )
| A. | Na+ | B. | H2O | C. | F | D. | Ne |
10.下列离子与氖原子核外电子排布不相同的是( )
| A. | Na+ | B. | F- | C. | Al3+ | D. | S2- |
 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).