题目内容
在一定条件下,反应:H2(g)+I2 (g)?2HI(g)△H<0在一密闭体系中达到化学平衡.
(1)请写出该反应的平衡常数表达式K=
(2)改变下列条件时,平衡向正向移动的是
A 保持压强不变,升高温度
B 保持温度不变,通入氢气
C 保持温度不变,缩小容器的体积.
(1)请写出该反应的平衡常数表达式K=
(2)改变下列条件时,平衡向正向移动的是
A 保持压强不变,升高温度
B 保持温度不变,通入氢气
C 保持温度不变,缩小容器的体积.
考点:化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)A 保持压强不变,升高温度,向吸热反应方向移动;
B 保持温度不变,通入氢气,增加反应物的浓度;
C 保持温度不变,缩小容器的体积,相当增大压强.
(2)A 保持压强不变,升高温度,向吸热反应方向移动;
B 保持温度不变,通入氢气,增加反应物的浓度;
C 保持温度不变,缩小容器的体积,相当增大压强.
解答:
解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=
,故答案为:K=
;
(2)A 保持压强不变,升高温度,向吸热反应方向移动,逆向移动,故A错误;
B 保持温度不变,通入氢气,增加反应物的浓度平衡正向移动,故B正确;
C 保持温度不变,缩小容器的体积,相当增大压强,平衡不移动,故C错误,
故选B.
| c2(HI) |
| c(H2)c(I2) |
| c2(HI) |
| c(H2)c(I2) |
(2)A 保持压强不变,升高温度,向吸热反应方向移动,逆向移动,故A错误;
B 保持温度不变,通入氢气,增加反应物的浓度平衡正向移动,故B正确;
C 保持温度不变,缩小容器的体积,相当增大压强,平衡不移动,故C错误,
故选B.
点评:本题主要考查了平衡常数、化学平衡移动,难度不大,对于两边计量数相等的,增大压强平衡不移动.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
下列叙述中,正确的是( )
| A、如果加四氯化碳呈现紫色,证明原溶液中存在I- |
| B、加入盐酸产生白色沉淀的溶液一定是硝酸银溶液 |
| C、二氧化硅是酸性氧化物,能够与水反应生成酸 |
| D、氢氟酸是弱酸,但会腐蚀玻璃 |
在标准状况下,将CO2和CO的混合气体(密度是H2的16倍)充满一盛有足量Na2O2的 密闭容器中(容积为22.4L),用间断的电火花引发至充分反应.反应完全后容器里的存在物叙述正确的是 ( )
| A、存在0.5 mol的CO |
| B、存在0.125 mol的O2 |
| C、存在0.25 mol的Na2CO3 |
| D、存在1.25 mol的Na2CO3 |
我国劳动人民在3000多年前就制造出精美的青铜器,青铜是铜锡合金,具有良好的可铸造性.耐磨性和耐腐蚀性.取青铜样品8.1g,经分析其中含锡0.9g,此青铜中铜与锡的质量比是( )
| A、9:2 | B、9:1 |
| C、8:1 | D、4:1 |
将植物油和水分离的方法是( )
| A、过滤 | B、蒸馏 | C、分液 | D、萃取 |
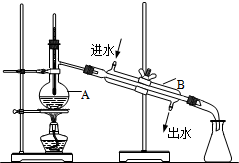 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.