题目内容
7.下列说法不正确的是( )| A. | 参加反应物质的性质是决定化学反应速率的主要因素 | |
| B. | 光是影响某些化学反应速率的外界条件之一 | |
| C. | 决定化学反应速率的主要因素是浓度 | |
| D. | 增大浓度、加热、加压或使用催化剂,都是加快反应速率的方法 |
分析 影响化学反应速率的因素有内因和外因,物质的性质为内因,为影响化学反应速率的主要因素,外因有温度、浓度、压强、催化剂等,其中催化剂只改变反应速率,但不能概念反应的方向,当可逆反应达到平衡状态时,正逆反应速率相等,反应达到化学反应限度,此时各物质的浓度不再发生改变,但化学平衡为动态平衡,当外界条件发生变化时,平衡发生移动.以此解答该题.
解答 解:A.反应物的性质为决定化学反应速率的主要因素,如钠能和冷水反应,铜和热水也不反应,故A正确;
B.有些反应在光照条件下可发生,如HClO的分解,则光是影响某些化学反应速率的外界条件之一,故B正确;
C.决定化学反应速率的主要因素是物质的本身性质,故C错误;
D.增大浓度、加热、加压或使用催化剂,可增大单位体积活化分子数目,反应速率增大,故D正确.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点和常见题型,注意把握内因和外因的区别,特别是催化剂的性质,为该题考查的侧重点,注意相关基础知识的积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.取两份质量相等的有机物M,一份与足量的钠反应放出气体V1升,另一份与足量Na2CO3溶液反应放出气体V2升;若同温同压下V1>V2,则M可能是( )
| A. | CH3COOH | B. | HOOC-COOH | C. | HO(CH2)2CHO | D. | HOC6H4COOH |
18.近年来,科学家研制了一种新型的乙醇燃料电池,它用酸性电解质(H+)作溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是( )
| A. | 乙醇在电池的负极上参加反应 | |
| B. | 1mol CH3CH2OH被氧化转移6mole- | |
| C. | 随着反应的进行,正极附近的酸性减弱 | |
| D. | 电池放电过程中化学能转化成电能 |
15.肉桂醛常用于牙膏、口香糖、口气清新剂等口腔护理品,其结构简式如图所示.工业上电解肉桂醇制备肉桂醛,下列说法不正确的是( )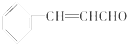
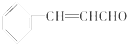
| A. | 煮沸肉桂醛与新制Cu(OH)2的混合物有砖红色沉淀生成 | |
| B. | 电解肉桂醇制得的肉桂醛在电解池的阳极生成 | |
| C. | 仅用新制银氨溶液和溴水不能鉴别肉桂醛中的碳碳双键 | |
| D. | 13.2g肉桂醛分子中含有碳碳双键数目为0.4NA |
19.碳酸锂(相对分子质量74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业.制备流程如下:
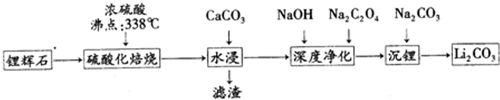
已知:碳酸锂的溶解度为( g/L)
(1)锂辉石(Li2Al2Si4Ox)可以用氧化物的形式表示其组成形式为Li2O•Al2O3•4SiO2.
(2)硫酸化焙烧工业反应温度控制在250-300℃,主要原因是温度低于250℃,反应速率较慢;温度高于300℃,硫酸挥发较多;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则ABC(填入选项代号).
A.增加酸耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是除去多余的硫酸,同时调整pH,除去大部分杂质.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主要原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.

已知:碳酸锂的溶解度为( g/L)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(2)硫酸化焙烧工业反应温度控制在250-300℃,主要原因是温度低于250℃,反应速率较慢;温度高于300℃,硫酸挥发较多;同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则ABC(填入选项代号).
A.增加酸耗量 B.增加后续杂质的处理量 C.增加后续中和酸的负担
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是除去多余的硫酸,同时调整pH,除去大部分杂质.
(4)“沉锂”的化学反应方程式为Na2CO3+Li2SO4=Li2CO3↓+Na2SO4.
(5)“沉锂”需要在95℃以上进行,主要原因是温度越高,碳酸锂溶解度降低,可以增加产率.过滤碳酸锂所得母液中主要含有硫酸钠,还可能含有碳酸钠和碳酸锂.
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g氮气含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的水分子数为NA | |
| C. | 1molOH-含有的电子数为10NA | |
| D. | 0.1L 1mol/L NaCl溶液中含有Na+个数为NA |
5.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①计算该反应第一次达平衡时的平衡常数K0.135
②3min时改变的反应条件是升高温度或增大H2O的浓度或减小CO的浓度 (只填一种条件的改变即可).
(3)已知温度、压强、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O}$]对该反应的影响如图所示.
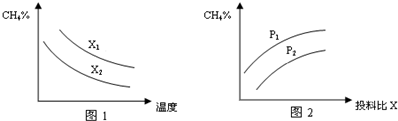
①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
②3min时改变的反应条件是升高温度或增大H2O的浓度或减小CO的浓度 (只填一种条件的改变即可).
(3)已知温度、压强、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O}$]对该反应的影响如图所示.

①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).