题目内容
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)写出与H2O分子互为等电子体的微粒 (填2种).
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
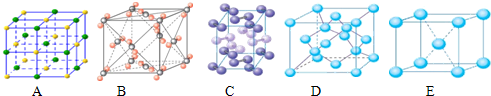
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图 (未按顺序排序).与冰的晶体类型相同的是 (请用相应的编号填写)
(5)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式: .
(1)水分子中氧原子在基态时核外电子排布式为
(2)写出与H2O分子互为等电子体的微粒
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图 (未按顺序排序).与冰的晶体类型相同的是

(5)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
考点:晶胞的计算,原子核外电子排布,“等电子原理”的应用
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)氧原子外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,据此写出氧原子外围电子排布图;
(2)原子个数相等、价电子数相等的微粒为等电子体;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3;
(4)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析;
(5)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形.
(2)原子个数相等、价电子数相等的微粒为等电子体;
(3)水中氧的杂化为sp3,H3O+中氧的杂化为sp3;
(4)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析;
(5)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,该络合离子为平面正方形.
解答:
解:(1)氧原子外围电子有6个电子,2s能级上有2个电子,2p能级上有4个电子,其外围电子排布式为1s22s22p4,
故答案为:1s22s22p4;
(2)原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒有:H2S、NH2-,
故答案为:H2S、NH2-;
(3)A、水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A不合理;
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B合理;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;
D、水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D合理;
故答案为:A;
(4)冰属于分子晶体,由晶胞图可知,B为干冰的晶胞图,构成微粒为分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,故答案为:BC;
(5)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
故答案为:1s22s22p4;
(2)原子个数相等、价电子数相等的微粒为等电子体,与水互为等电子体的微粒有:H2S、NH2-,
故答案为:H2S、NH2-;
(3)A、水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,故A不合理;
B、水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,故B合理;
C、因结构不同,则性质不同,微粒的化学性质发生了改变,故C合理;
D、水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,故D合理;
故答案为:A;
(4)冰属于分子晶体,由晶胞图可知,B为干冰的晶胞图,构成微粒为分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,故答案为:BC;
(5)将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,生成此配合离子的离子方程式为Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
点评:本题考查物质结构与性质,明确原子序数、电子排布、等电子体、空间构型、分子极性的判断等知识即可解答,难度中等

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
下列说法中,不科学的是( )
| A、染发剂一般都具有一定的刺激性,使用时要注意安全 |
| B、烫发是一种不可逆转的化学过程,一旦烫发后,就不能再将卷曲的头发烫直,因此要“三思而烫” |
| C、药物牙膏具有预防和治疗口腔疾病的功能,但是由于刷牙时牙膏在口腔内停留时间很短且药物浓度较低,因此在预防和治疗口腔疾病时不能把希望寄托在各种药物牙膏上,有牙病应当及时到医院进行治疗 |
| D、所有的化妆品都有保质期,过期的化妆品对人体健康会产生危害 |
短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等.下列叙述正确的是( )
| A、原子半径:C<B |
| B、元素A、C的氧化物均为共价化合物 |
| C、金属性:D>C |
| D、元素B、C、D的最高价氧化物对应水化物能相互反应 |
2013年3月23日20点30分开始“地球一小时”熄灯活动,今年的主题是:我做绿V客,“环保七选一,每周一起来”,以倡导节能减排理念.下列不能达到节能减排目的是( )
| A、利用太阳能制氢 |
| B、用家用汽车代替公交车 |
| C、利用化石燃料制造燃料电池 |
| D、用节能灯代替白炽灯 |
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.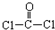 ,每个COCl2分子内含有
,每个COCl2分子内含有