题目内容
短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等.下列叙述正确的是( )
| A、原子半径:C<B |
| B、元素A、C的氧化物均为共价化合物 |
| C、金属性:D>C |
| D、元素B、C、D的最高价氧化物对应水化物能相互反应 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期元素A、B、C、D的原子序数依次增大,A是原子半径最小的原子,应为H元素,A和C同主族,则C应为Na元素,B位于第VA族,应为N元素,D原子最外层电子数与电子层数相等,应为Al元素,结合对应的单质、化合物的性质以及元素周期律知识解答该题.
解答:
解:短周期元素A、B、C、D的原子序数依次增大,A是原子半径最小的原子,应为H元素,A和C同主族,则C应为Na元素,B位于第VA族,应为N元素,D原子最外层电子数与电子层数相等,应为Al元素,
A.B为N元素,C为Na元素,Na原子半径较大,故A错误;
B.C为Na元素,对应的氧化物为离子化合物,故B错误;
C.同周期元素从左到右元素的金属性逐渐减弱,金属性Na>Al,故C错误;
D.元素B、C、D的最高价氧化物对应水化物分别为HNO3、NaOH、Al(OH)3,其中Al(OH)3为两性氢氧化物,可相互反应,故D正确.
故选D.
A.B为N元素,C为Na元素,Na原子半径较大,故A错误;
B.C为Na元素,对应的氧化物为离子化合物,故B错误;
C.同周期元素从左到右元素的金属性逐渐减弱,金属性Na>Al,故C错误;
D.元素B、C、D的最高价氧化物对应水化物分别为HNO3、NaOH、Al(OH)3,其中Al(OH)3为两性氢氧化物,可相互反应,故D正确.
故选D.
点评:本题考查原子结构与元素周期律知识,侧重于学生的分析能力的考查,注意元素周期律及元素对应的单质、化合物的性质,元素的推断是解答本题的关键,注意把握题中原子半径大小关系,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
根据所学知识,判断下列反应不能发生的是( )
| A、Cl2+2KBr═2KCl+Br2 | ||||
| B、2NaCl+I2═Cl2+2NaI | ||||
| C、Cl2+2HI═2HCl+I2 | ||||
D、MnO2+4HCl(浓)
|
化石燃料仍然是当今世界上使用最多的能源,化石燃料的利用还存在着有待解决的问题,化学科学的发展为解决燃料利用中的问题提供了可能,下列做法不适宜的是( )
| A、研究燃料充分燃烧的条件,提高燃料的利用率 |
| B、在煤炭燃烧过程中加入生石灰,减少二氧化硫的排放 |
| C、开发氢能、核能、太阳能等洁净、高效的新能源 |
| D、大力发展火力发电以缓解电力供应不足的情况 |
下列关于芳香烃的叙述中不正确的是( )
| A、乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 |
| B、苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在100℃时即可生成三硝基甲苯,说明甲基对苯环产生了影响 |
| C、甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤 |
| D、除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可 |
几种短周期元素的原子半径及主要化合价如表,下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A、R的氧化物对应的水化物可能具有两性 |
| B、L、Q形成的简单离子核外电子数相等 |
| C、T、Q的氢化物常态下均为无色气体 |
| D、L、M的单质与稀硫酸反应速率:M>L |
下列表示对应化学反应的离子方程式正确的是( )
A、向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O
| ||
B、苯酚钠溶液中通入少量CO2: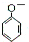 +H2O+CO2→ +H2O+CO2→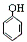 +HCO3- +HCO3- | ||
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O | ||
| D、氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O |