题目内容
研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题:
(1)O、Si、N元素的电负性由大到小的顺序是 .C60和金刚石都是碳的同素异形体,二者比较熔点高的是 ,原因是 .
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①COCl2分子的结构式为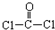 ,每个COCl2分子内含有 个δ键, 个π键.其中心原子采取 杂化轨道方式.
,每个COCl2分子内含有 个δ键, 个π键.其中心原子采取 杂化轨道方式.
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 .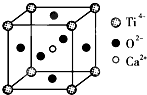
(3)CaTiO3晶体中(晶胞结构如图所示),晶体中,Ti4+的氧配位数为 ;晶体中,若将Ti4+置于立方体的体心,Ca2+置于立方体的顶点,则O2-处于立方体的 .
(1)O、Si、N元素的电负性由大到小的顺序是
(2)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①COCl2分子的结构式为
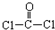 ,每个COCl2分子内含有
,每个COCl2分子内含有②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)反应过程中,断裂的化学键只有配位键,则形成的化学键类型是

(3)CaTiO3晶体中(晶胞结构如图所示),晶体中,Ti4+的氧配位数为
考点:晶胞的计算,元素电离能、电负性的含义及应用,共价键的形成及共价键的主要类型,判断简单分子或离子的构型,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)根据元素的电负性在周期表中的递变规律以及晶体的类型与熔沸点的关系解答该题;
(2)C=O键中含有1个δ键,1个π键;根据生成物判断形成的化学键;
(3)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数;根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上.
(2)C=O键中含有1个δ键,1个π键;根据生成物判断形成的化学键;
(3)观察晶胞,数数Ti周围距离最近的O的个数即为Ti的配位数;根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上.
解答:
解:(1)同周期元素从左到右元素的电负性逐渐增强,则电负性:O>N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>O>Si,C60是分子晶体,而金刚石是原子晶体,原子晶体的熔沸点远大于分子晶体,
故答案为:N>C>Si;金刚石;金刚石是原子晶体,C60是分子晶体;
(2)①C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,所以C原子为sp2杂化,故答案为:3;1;sp2;
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,则形成金属键,故答案为:金属键;
(3)观察晶胞结构,可知钛位于晶胞的顶点,周围距离最近的氧原子有12个,分别位于与钛相连的12个面的面心上,则钛的氧配位数为12;根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上,
故答案为:12;面心.
故答案为:N>C>Si;金刚石;金刚石是原子晶体,C60是分子晶体;
(2)①C=O键中含有1个δ键,1个π键,则COCl2分子内含有3个σ键、1个π键,所以C原子为sp2杂化,故答案为:3;1;sp2;
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,则形成金属键,故答案为:金属键;
(3)观察晶胞结构,可知钛位于晶胞的顶点,周围距离最近的氧原子有12个,分别位于与钛相连的12个面的面心上,则钛的氧配位数为12;根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上,
故答案为:12;面心.
点评:本题主要考查了电负性、不同类型晶体性质的比较、配合物的结构、晶胞的计算等知识点,涉及知识点较多,中等难度.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
下列关于芳香烃的叙述中不正确的是( )
| A、乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 |
| B、苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在100℃时即可生成三硝基甲苯,说明甲基对苯环产生了影响 |
| C、甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤 |
| D、除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可 |
下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是( )
A、 |
B、 |
C、 |
D、 |
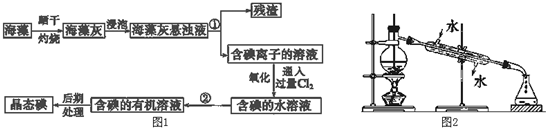


 实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题: