题目内容
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.(1)Cu2+基态的电子排布式可表示为
(2)SO42-的空间构型为
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是
(5)CuS比CuO的熔点
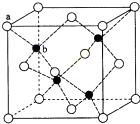
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为
考点:原子核外电子排布,判断简单分子或离子的构型,“等电子原理”的应用,晶体熔沸点的比较,晶胞的计算
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写;
(2)计算S原子的价电子对数进行判断;具有相同原子数和价电子数的微粒互称为等电子体;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键;
(4)根据沉淀转化原理分析;
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高;
(6)利用均摊法计算晶胞中含有的硫原子和锌原子,根据ρ=
计算密度;每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270
pm,根据余弦定理计算白球和黑球之间的距离.
(2)计算S原子的价电子对数进行判断;具有相同原子数和价电子数的微粒互称为等电子体;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键;
(4)根据沉淀转化原理分析;
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高;
(6)利用均摊法计算晶胞中含有的硫原子和锌原子,根据ρ=
| ||
| V |
| 2 |
解答:
解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)SO42-的价电子对数=
=4,形成四条杂化轨道,S原子的杂化方式为sp3,形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42-互为等电子体的微粒有SiCl4等;
故答案为:正四面体;sp3;SiCl4;
(3))[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,
,
故答案为: ;
;
(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS;
故答案为:在相同温度下,Ksp(CuS)<Ksp(ZnS);
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2-比S2-半径小,所以CuO的熔点比CuS高;
故答案为:低;CuO晶格能比CuS大;
(6)黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数=
×8+
×6=4,ρ=
=
=4.1g/(cm)3,
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270
pm,设S2-离子与Zn2+离子之间的距离为x,2x2-2x2cos109°28′=(270
)2,x=
=
pm;
故答案为:4.1g/(cm)3;
.
故答案为:1s22s22p63s23p63d9;
(2)SO42-的价电子对数=
| 6+2 |
| 2 |
故答案为:正四面体;sp3;SiCl4;
(3))[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为
 ,
,故答案为:
 ;
;(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS;
故答案为:在相同温度下,Ksp(CuS)<Ksp(ZnS);
(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2-比S2-半径小,所以CuO的熔点比CuS高;
故答案为:低;CuO晶格能比CuS大;
(6)黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数=
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| V |
| ||
| (540×10-10cm)3 |
每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270
| 2 |
| 2 |
|
| 270 | ||
|
故答案为:4.1g/(cm)3;
| 270 | ||
|
点评:本题考查了核外电子的排布、分子的空间构型、配位键、晶胞的计算等知识点,难度较大,会利用均摊法计算晶胞中含有的离子,注意运用余弦定理计算硫离子和锌离子之间的距离,为难点.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池.已知该电池总反应为:2CO+O2═2CO2.则下列说法中正确的是( )
| A、通CO的一极是电池的正极 |
| B、该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C、负极反应式:O2+2CO2+4e-═2CO32- |
| D、该电池工作过程中有蓝色火焰产生 |
下列关于芳香烃的叙述中不正确的是( )
| A、乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 |
| B、苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在100℃时即可生成三硝基甲苯,说明甲基对苯环产生了影响 |
| C、甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤 |
| D、除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可 |
下列表示对应化学反应的离子方程式正确的是( )
A、向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O
| ||
B、苯酚钠溶液中通入少量CO2: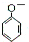 +H2O+CO2→ +H2O+CO2→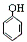 +HCO3- +HCO3- | ||
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O | ||
| D、氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O |
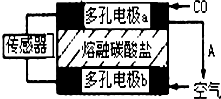 2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.
2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.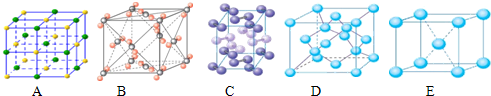
 实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题: