题目内容
下列说法正确的是( )
| A、当酸碱恰好完全中和时,溶液呈中性 |
| B、若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 |
| C、0.005 mol?L-1 Ba(OH)2溶液中,水电离出的c(OH-)为10-12 mol?L-1 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
考点:探究溶液的酸碱性,水的电离
专题:
分析:A.当酸碱恰好完全中和时,溶液可能呈酸性、碱性或中性;
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性;
C.0.005 mol?L-1 Ba(OH)2溶液中,则溶液中c(OH-)=2c[Ba(OH)2]=0.01mol/L,则水电离出的c(OH-)=c(H+);
D.含有弱离子的盐促进水电离.
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性;
C.0.005 mol?L-1 Ba(OH)2溶液中,则溶液中c(OH-)=2c[Ba(OH)2]=0.01mol/L,则水电离出的c(OH-)=c(H+);
D.含有弱离子的盐促进水电离.
解答:
解:A.当酸碱恰好完全中和时,溶液可能呈酸性、碱性或中性,如氯化铵呈酸性、氯化钠溶液呈中性、醋酸钠溶液呈碱性,故A错误;
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性,c(H+)>c(OH-)时溶液呈酸性,c(H+)<c(OH-)时溶液呈碱性,故B正确;
C.0.005 mol?L-1 Ba(OH)2溶液中,则溶液中c(OH-)=2c[Ba(OH)2]=0.01mol/L,则水电离出的c(OH-)=c(H+),温度未知,水的离子积常数未知,则溶液中水电离出c(OH-)无法计算,故C错误;
D.含有弱离子的盐促进水电离,NaCl为强酸强碱盐,不影响水电离,醋酸铵是弱酸弱碱盐,促进水电离,故D错误;
故选B.
B.如果溶液中c(H+)=c(OH-),则溶液肯定呈中性,c(H+)>c(OH-)时溶液呈酸性,c(H+)<c(OH-)时溶液呈碱性,故B正确;
C.0.005 mol?L-1 Ba(OH)2溶液中,则溶液中c(OH-)=2c[Ba(OH)2]=0.01mol/L,则水电离出的c(OH-)=c(H+),温度未知,水的离子积常数未知,则溶液中水电离出c(OH-)无法计算,故C错误;
D.含有弱离子的盐促进水电离,NaCl为强酸强碱盐,不影响水电离,醋酸铵是弱酸弱碱盐,促进水电离,故D错误;
故选B.
点评:本题考查溶液酸碱性、盐类水解、水的电离等知识点,综合性较强,溶液酸碱性要根据c(H+)、c(OH-)相对大小判断,不能根据溶液pH大小判断,易错选项是C,题目难度中等.

练习册系列答案
相关题目
用0.1mol/LNaOH溶液滴定0.1mol/L盐酸溶液,如达到滴定终点时不慎多加了1滴NaOH溶液 (1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
| A、10 | B、9 |
| C、11.5 | D、12.5 |
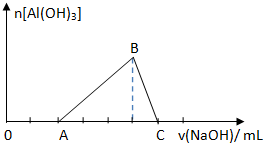 已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、B点两种沉淀共存,此时上层清液中c(Fe3+)=c(Al3+)=0 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104:1 |
| D、C点溶液中的溶质只有NaAlO2 |
下列离子方程式正确的是( )
A、等物质的量的NH4HCO3与Ba(OH)2溶液混合后加热:NH4++OH-
| ||||
| B、酸性的淀粉碘化钾溶液在空气中变蓝:4I-+O2+4H+=2H2O+2I2 | ||||
| C、1molCl2通入含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | ||||
| D、过量SO2通入Ba(NO3)2溶液中:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ |


 是一种高分子材料,其单体的结构简式是
是一种高分子材料,其单体的结构简式是


 卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题:
卤族元素的单质和化合物很多,一氯化碘(ICl)、三氯化碘(ICl3),由于它们的性质与卤素相似,因此被称为卤素互化物.请利用所学物质结构与性质的相关知识回答下列问题: 和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6