题目内容
一定温度下,将4mol HCl 和1 mol O2 充入一恒容密闭容器中发生可逆反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g),下面示意图正确且说明反应达到平衡状态的是( )
A、 |
B、 |
C、 |
D、 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、体积不变,反应体系都是气体,密度始终不变,不能作为平衡状态的标志,故A错误;
B、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故B错误;
C、氧气和氯气的物质的之比不变,说明正逆反应速率相等,达平衡状态,故C正确;
D、未体现正与逆的关系,反应的正向速率不变,故D错误;
故选:C.
B、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故B错误;
C、氧气和氯气的物质的之比不变,说明正逆反应速率相等,达平衡状态,故C正确;
D、未体现正与逆的关系,反应的正向速率不变,故D错误;
故选:C.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1 mol甲烷含有的电子数为NA |
| B、1 L 0.1 mol/L Na2CO3溶液中含有的CO3数目为0.1 NA |
| C、1 L pH=1的硫酸溶液中含有的H+数为0.2 NA |
| D、标准状况下,2.24 L CO和CO2混合气体中含有的氧原子数为0.15NA |
溶液、胶体和浊液这三种分散系的根本区别是( )
| A、是否均一、稳定、透明 |
| B、分散质微粒直径的大小 |
| C、能否透过滤纸 |
| D、分散质的粒子是否为大量分子或离子的集合体 |
用0.1mol/LNaOH溶液滴定0.1mol/L盐酸溶液,如达到滴定终点时不慎多加了1滴NaOH溶液 (1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是( )
| A、10 | B、9 |
| C、11.5 | D、12.5 |
 某溶液中可能含有,OH-、CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图.下列判断正确的是( )
某溶液中可能含有,OH-、CO32-,AlO2-,SiO32-,SO42-,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图.下列判断正确的是( )| A、原溶液中一定含有Na2SO4 |
| B、原溶液中一定含有的阴离子是OH-,CO32-,SiO32-,AlO2- |
| C、反应后形成的溶液溶质为NaCl |
| D、原溶液中含有CO32-与AlO2-的物质的量比为1:2 |
下列解释事实的离子方程式正确的是( )
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| B、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2=2HClO+CO32- |
| C、向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
| D、0.01 mol?L-1NH4Al(SO4)2溶液与0.02 mol?L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
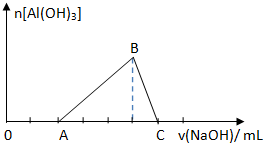 已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成Al(OH)3沉淀的物质的量与加入NaOH溶液体积的关系如图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、B点两种沉淀共存,此时上层清液中c(Fe3+)=c(Al3+)=0 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104:1 |
| D、C点溶液中的溶质只有NaAlO2 |
 子式
子式 1mol最多能与
1mol最多能与 中,共平面的碳原子最多有
中,共平面的碳原子最多有